Ewolucja złożoności chemicznej
 Jak powstało życie na Ziemi? Chemiczna lub molekularna ewolucja poprzedziła
pojawienie się życia. Pod wpływem energii niskiej entropii ze Słońca i wspomagane przez obecność pewnych skał, atomy i cząsteczki przeszły reakcje
chemiczne, których rezultatem było pojawienie się cząsteczek o coraz wyższej
zawartości informacyjnej lub złożoności. W tym artykule wyjaśniam, jak to się
zdarzyło.
Jak powstało życie na Ziemi? Chemiczna lub molekularna ewolucja poprzedziła
pojawienie się życia. Pod wpływem energii niskiej entropii ze Słońca i wspomagane przez obecność pewnych skał, atomy i cząsteczki przeszły reakcje
chemiczne, których rezultatem było pojawienie się cząsteczek o coraz wyższej
zawartości informacyjnej lub złożoności. W tym artykule wyjaśniam, jak to się
zdarzyło.
8.1 Od atomów do cząsteczek
Chemiczny symbol H jest używany dla atomu wodoru, który jest pierwszym pierwiastkiem w układzie okresowym pierwiastków. Ma jądro, które w tym wypadku jest tylko protonem, i jest tam elektron krążący wokół jądra. Elektron ma ładunek ujemny, dokładnie równy wielkością dodatniemu ładunkowi protonu. Przyjmując tę wielkość jako ładunek jednostkowy, mówimy, że atom H ma liczbę atomową 1 (Z=1). Przyjmując masę protonu za jednostkę masy mówimy, że H ma liczbę masową 1(A=1). Elektron jest ~2000 razy lżejszy niż proton.
Pierwiastkiem numer 2 w układzie okresowym jest hel (symbol chemiczny He). Ma dwa protony w jądrze i dwa elektrony krążące wokół jądra. W jądrze są także dwa neutrony. Neutrony otrzymały swoją nazwę, ponieważ nie mają ładunku. Masa neutronu niezbyt różni się od masy protonu. Tak więc dla atomu He, Z=2 i A=4.
Życie na Ziemi oparte jest na chemii organicznej tj. chemii atomu węgla, oznaczanego przez symbol C. Dla tego atomu Z=6 i A=12.
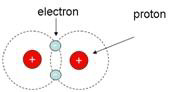
Cząsteczka wodoru oznaczona jest symbolem H2. Składa się z dwóch jąder wodoru i są tam dwa krążące wokół nich elektrony. Dlaczego wodór „woli" istnieć jako H2 niż jako H? Ponieważ H2 jest stabilniejszy niż H. Dlaczego? Rozważmy dwa elektrony H2. Mechanika kwantowa powiada, że nie mają one indywidualności i są dlatego nierozróżnialne. Popatrzmy na jeden z nich. Ponieważ ładunki dodatni i ujemny przyciągają się, elektrony pozostają blisko (ale nie za blisko) tych dwóch jąder. [Gdyby nie zasada nieoznaczoności Heisenberga, elektrony wszystkich atomów wpadłyby prosto do swoich jąder i nie byłoby nas tutaj, żeby dyskutować o chemicznej złożoności!] Naturalnie, dodatnie ładunki dwóch jąder H2 są lepsze niż tylko jeden dodatni ładunek w H2, kiedy chodzi o wywieranie siły przyciągania na elektron. Tak więc H2 jest stabilniejszy (ma niższą energię wewnętrzną) niż H, ponieważ jest silniej związany. Tak więc atomy H tworzą cząsteczki H2, ponieważ dzięki temu zmniejsza się ogólna energia swobodna (druga zasada termodynamiki wymaga, by energia swobodna była tak mała, jak to możliwe). Tworzenie się H2 z dwóch atomów H jest przykładem ewolucji złożoności chemicznej. Potrzeba więcej informacji do opisu struktury i funkcji H2 niż H.
Jaka jest natura wiązania między dwoma atomami H2 lub H-H? Opisuje się je jako wiązanie kowalentne. Każdy z dwóch atomów H daje swój elektron do chemicznego wiązania między nimi i te dwa elektrony w rejonie wiążącym należą do obu jąder.
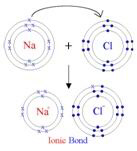
 Innym rodzajem chemicznego wiązania jest tak zwane
wiązanie elektrowalentne (zwane także wiązaniem jonowym). Jest to
wiązanie, które zachodzi między odwrotnie naładowanymi jonami. Weźmy
chlorek sodu (NaCl). Dla atomu Na Z=11 i dla atomu chlorku Z=17. Prawa mechaniki
kwantowej są takie, że atom Na jest stabilniejszy, jeśli jest otoczony przez
tylko10 elektronów zamiast 11. Podobnie Cl jest stabilniejsze, jeśli ma 18
elektronów zamiast 17. Razem mogą rozwiązać ten problem przez skłonność do
„jonizacji"; tj. atom Na może stać się dodatnio naładowanym jonem Na+
przez utratę elektronu (zwanego elektronem walencyjnym), a atom Cl może
stać się ujemnie naładowanym jonem Cl- przez zyskanie elektronu. Te
dwa odwrotnie naładowane jony mogą obniżyć energię potencjalną (a więc energię
swobodną) przez zbliżenie się do siebie, tworząc między sobą wiązanie jonowe.
Innym rodzajem chemicznego wiązania jest tak zwane
wiązanie elektrowalentne (zwane także wiązaniem jonowym). Jest to
wiązanie, które zachodzi między odwrotnie naładowanymi jonami. Weźmy
chlorek sodu (NaCl). Dla atomu Na Z=11 i dla atomu chlorku Z=17. Prawa mechaniki
kwantowej są takie, że atom Na jest stabilniejszy, jeśli jest otoczony przez
tylko10 elektronów zamiast 11. Podobnie Cl jest stabilniejsze, jeśli ma 18
elektronów zamiast 17. Razem mogą rozwiązać ten problem przez skłonność do
„jonizacji"; tj. atom Na może stać się dodatnio naładowanym jonem Na+
przez utratę elektronu (zwanego elektronem walencyjnym), a atom Cl może
stać się ujemnie naładowanym jonem Cl- przez zyskanie elektronu. Te
dwa odwrotnie naładowane jony mogą obniżyć energię potencjalną (a więc energię
swobodną) przez zbliżenie się do siebie, tworząc między sobą wiązanie jonowe.
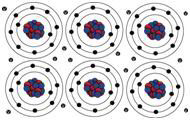
 Trzecim ważnym i ogólnie silnym wiązaniem jest
wiązanie metaliczne. Zachodzi w metalach takich jak aluminium (Al), miedź
(Cu), srebro (Ag), złoto (Au) itd. Weźmy przypadek Al. Dla niego Z=13. Ale,
podobnie jak atom Na omawiany wyżej, jest bardziej stabilny, jeśli ma tylko 10
elektronów wokół jądra. Tak więc atomy Al, kiedy są blisko jeden drugiego, tracą
trzy elektrony walencyjne do wspólnej puli i te elektrony walencyjne stają się
wspólną własnością wszystkich jonów Al. Kawałek metalu Al trzyma się razem
dzięki tej chmurze ujemnie naładowanych elektronów, kompensujących dodatnie
ładunki jonów Al.
Trzecim ważnym i ogólnie silnym wiązaniem jest
wiązanie metaliczne. Zachodzi w metalach takich jak aluminium (Al), miedź
(Cu), srebro (Ag), złoto (Au) itd. Weźmy przypadek Al. Dla niego Z=13. Ale,
podobnie jak atom Na omawiany wyżej, jest bardziej stabilny, jeśli ma tylko 10
elektronów wokół jądra. Tak więc atomy Al, kiedy są blisko jeden drugiego, tracą
trzy elektrony walencyjne do wspólnej puli i te elektrony walencyjne stają się
wspólną własnością wszystkich jonów Al. Kawałek metalu Al trzyma się razem
dzięki tej chmurze ujemnie naładowanych elektronów, kompensujących dodatnie
ładunki jonów Al.
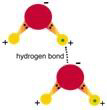
8.2 Wiązanie wodorowe i wiązanie van der Waalsa
 Opisane powyżej wiązania kowalentne, elektrowalentne i metaliczne są tak zwanymi wiązaniami pierwotnymi. Są to silne wiązania.
Na przykład diament składa się z kowalentnie związanych atomów węgla i jest
bardzo twardym materiałem. Także w metalach atomy są silnie związane ze sobą,
jak również w kryształach chlorku sodu, w których dominuje interakcja
elektrowalentna. Istnieje szereg innych typów wiązań lub interakcji, które są
znacznie słabsze, ale bardzo ważne, szczególnie dla układów biologicznych i ogólnie dla miękkiej materii. Szczególnie wszechobecne jest wiązanie
wodorowe. Weźmy przykład wody, H2O lub H-O-H. Atom tlenu tworzy
kowalentne wiązania z dwoma atomami wodoru. Każde takie kowalentne wiązanie (O-H)
ma stowarzyszone z nim dwa elektrony, jeden pochodzący z wodoru i jeden z tlenu.
Dystrybucja elektronu wokół dwóch jąder wodoru w takim wiązaniu nie jest taka
jak w symetrycznym wiązaniu C-C w strukturze diamentu. Jądro tlenu ma
liczbę atomową 8, co jest znacznie więcej niż liczba atomowa 1 wodoru, a więc
okupuje większą część chmury ładunku elektronu stowarzyszonego z wiązaniem
(mówimy, że atom tlenu jest bardzo elektroujemny). To powoduje, że jądro
atomu wodoru jest nieco mniej osłonięte przez elektron, który krążył wokół
niego, kiedy nie było żadnego rodzaju wiązania. Z podobnych przyczyn jądro tlenu i jego chmura ładunku elektronów są razem trochę bardziej ujemne niż byłyby w izolowanym atomie O. Końcowym wynikiem jest to, że cząsteczka wody jest jak mały
dipol (dwubiegun). Ma twa dodatnie końce i jeden ujemny. Wszystkie
cząsteczki wody są dipolami, a więc ustawiają się tak, że dodatni koniec
(wodorowy) jednej cząsteczki wskazuje ku ujemnemu końcowi (tlenowemu) drugiej
cząsteczki. Mówimy więc o wiązaniu wodorowym, oznaczonym w tym przykładzie przez
O-H...O.
Opisane powyżej wiązania kowalentne, elektrowalentne i metaliczne są tak zwanymi wiązaniami pierwotnymi. Są to silne wiązania.
Na przykład diament składa się z kowalentnie związanych atomów węgla i jest
bardzo twardym materiałem. Także w metalach atomy są silnie związane ze sobą,
jak również w kryształach chlorku sodu, w których dominuje interakcja
elektrowalentna. Istnieje szereg innych typów wiązań lub interakcji, które są
znacznie słabsze, ale bardzo ważne, szczególnie dla układów biologicznych i ogólnie dla miękkiej materii. Szczególnie wszechobecne jest wiązanie
wodorowe. Weźmy przykład wody, H2O lub H-O-H. Atom tlenu tworzy
kowalentne wiązania z dwoma atomami wodoru. Każde takie kowalentne wiązanie (O-H)
ma stowarzyszone z nim dwa elektrony, jeden pochodzący z wodoru i jeden z tlenu.
Dystrybucja elektronu wokół dwóch jąder wodoru w takim wiązaniu nie jest taka
jak w symetrycznym wiązaniu C-C w strukturze diamentu. Jądro tlenu ma
liczbę atomową 8, co jest znacznie więcej niż liczba atomowa 1 wodoru, a więc
okupuje większą część chmury ładunku elektronu stowarzyszonego z wiązaniem
(mówimy, że atom tlenu jest bardzo elektroujemny). To powoduje, że jądro
atomu wodoru jest nieco mniej osłonięte przez elektron, który krążył wokół
niego, kiedy nie było żadnego rodzaju wiązania. Z podobnych przyczyn jądro tlenu i jego chmura ładunku elektronów są razem trochę bardziej ujemne niż byłyby w izolowanym atomie O. Końcowym wynikiem jest to, że cząsteczka wody jest jak mały
dipol (dwubiegun). Ma twa dodatnie końce i jeden ujemny. Wszystkie
cząsteczki wody są dipolami, a więc ustawiają się tak, że dodatni koniec
(wodorowy) jednej cząsteczki wskazuje ku ujemnemu końcowi (tlenowemu) drugiej
cząsteczki. Mówimy więc o wiązaniu wodorowym, oznaczonym w tym przykładzie przez
O-H...O.
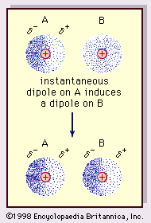 Najbardziej istotnym aspektem wiązania wodorowego w ewolucji chemicznej i biologicznej złożoności jest to, że jest ono stosunkowo słabe, nie tak
silne jak wiązanie kowalentne, ale nie tak słabe jak tak zwane wiązanie van der
Waalsa (lub oddziaływanie dyspersyjne Londona). Oddziaływanie van der Waalsa
jest bardzo słabe, chociaż zawsze obecne między dwoma atomami. Fluktuacje
kwantowo-mechaniczne w chmurze ładunku elektronicznego wokół atomu mogą
spowodować przejściowe rozdzielenie ładunku lub moment dipolowy albo multipolowy, a pole elektryczne tego multipola indukuje moment multipolowy w każdym sąsiednim
atomie. Powoduje to małe przyciąganie miedzy dwoma atomami.
Najbardziej istotnym aspektem wiązania wodorowego w ewolucji chemicznej i biologicznej złożoności jest to, że jest ono stosunkowo słabe, nie tak
silne jak wiązanie kowalentne, ale nie tak słabe jak tak zwane wiązanie van der
Waalsa (lub oddziaływanie dyspersyjne Londona). Oddziaływanie van der Waalsa
jest bardzo słabe, chociaż zawsze obecne między dwoma atomami. Fluktuacje
kwantowo-mechaniczne w chmurze ładunku elektronicznego wokół atomu mogą
spowodować przejściowe rozdzielenie ładunku lub moment dipolowy albo multipolowy, a pole elektryczne tego multipola indukuje moment multipolowy w każdym sąsiednim
atomie. Powoduje to małe przyciąganie miedzy dwoma atomami.
Miarą siły wiązania chemicznego jest energia wymagana do jego rozerwania. Temperatura topnienia ciała stałego jest wskazówką siły jego najsłabszego wiązania. Wiązanie kowalentne jest najsilniejsze, z typową energią wiązania ~400 kilokalorii (kcal). Wiązanie elekrowalentne jest zwykle o połowę słabsze. Wiązanie metaliczne wykazuje szeroki wachlarz siły, a dwoma skrajnymi przykładami jest wiązanie w rtęci na jednym krańcu i wiązanie w wolframie na drugim. Siła wiązania wodorowego zwykle wynosi 14 kcal. Wiązanie van der Waalsa zaś wymaga energii poniżej 1 kcal. Najbardziej istotnym faktem dla naszych rozważań tutaj jest to, że energia wymagana w wiązaniu wodorowym jest zwykle tylko ~10 razy większa od energii fluktuacji temperatury, ale nadal znacznie niższa od energii typowego wiązania kowalentnego. W typowych temperaturach, w których istnieją układy biologiczne, fluktuacjom temperatury trudno jest rozerwać wiązania kowalentne, ale istnieje dość wysoka szansa, że mogą rozerwać wiązania wodorowe.
8.3 Oddziaływania hydrofobowe i hydrofilowe
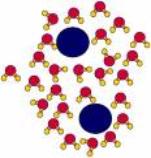 Widzieliśmy powyżej, że woda jest skupiskiem maleńkich dipoli. Mówimy, że jest
to materiał polarny. Natomiast istnieje duża liczba „węglowodorów", które są
materiałami niepolarnymi. [Węglowodór jest związkiem składającym się głównie z atomów wodoru i węgla]. W odróżnieniu od wiązania O-H w wodzie, które jest
wiązaniem z momentem dipolowym, wiązanie C-H w węglowodorze jest w przeważającym
stopniu niepolarne: dwa elektrony tworzące wiązanie kowalentne C-H dzielą się
niemal równo między C i H. Tak więc wiązanie C-H nie powoduje tworzenia dipolu i dlatego nie tworzy wiązania wodorowego z cząsteczką wody. A teraz załóżmy, że
mieszamy płyny polarne i niepolarne. Zajdzie segregacja. Molekuły
niepolarne będą miały tendencję do zbierania się razem, ponieważ nie mogą brać
udziału w wiązaniu wodorowym. Mają rodzaj „fobii" wobec cząsteczek wody, a więc
mówimy o oddziaływaniu hydrofobowym. Ponieważ wiązanie wodorowe jest średniej
siły, także oddziaływanie hydrofobowe jest średniej siły.
Widzieliśmy powyżej, że woda jest skupiskiem maleńkich dipoli. Mówimy, że jest
to materiał polarny. Natomiast istnieje duża liczba „węglowodorów", które są
materiałami niepolarnymi. [Węglowodór jest związkiem składającym się głównie z atomów wodoru i węgla]. W odróżnieniu od wiązania O-H w wodzie, które jest
wiązaniem z momentem dipolowym, wiązanie C-H w węglowodorze jest w przeważającym
stopniu niepolarne: dwa elektrony tworzące wiązanie kowalentne C-H dzielą się
niemal równo między C i H. Tak więc wiązanie C-H nie powoduje tworzenia dipolu i dlatego nie tworzy wiązania wodorowego z cząsteczką wody. A teraz załóżmy, że
mieszamy płyny polarne i niepolarne. Zajdzie segregacja. Molekuły
niepolarne będą miały tendencję do zbierania się razem, ponieważ nie mogą brać
udziału w wiązaniu wodorowym. Mają rodzaj „fobii" wobec cząsteczek wody, a więc
mówimy o oddziaływaniu hydrofobowym. Ponieważ wiązanie wodorowe jest średniej
siły, także oddziaływanie hydrofobowe jest średniej siły.
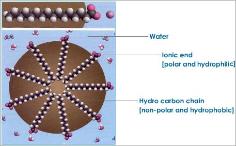 Istnieje wiele rodzajów związków organicznych, które
mają przeważającą strukturę węglowodorową, ale przyczepione do nich są
polarne grupy funkcjonalne. Przykładami tego rodzaju związków są
cholesterol, kwasy tłuszczowe i fosfolipidy. Takie cząsteczki mają niepolarny i hydrofobowy koniec oraz polarny, hydrofilowy koniec. Włożone do wody gromadzą
się same tak, że hydrofilowe końce kierują się ku wodzie, a hydrofobowe są
odsunięte, unikając kontaktu z wodą. To dlatego olej nie miesza się z wodą.
Natomiast alkohol i woda mieszają się tak łatwo, że nie potrzeba ich mieszać;
oba są płynami polarnymi. Zapomniałem nazwiska króla, który powiedział: „Nie
interesuje mnie, gdzie płynie woda, jak długo nie dostaje się do mojego wina!"
Istnieje wiele rodzajów związków organicznych, które
mają przeważającą strukturę węglowodorową, ale przyczepione do nich są
polarne grupy funkcjonalne. Przykładami tego rodzaju związków są
cholesterol, kwasy tłuszczowe i fosfolipidy. Takie cząsteczki mają niepolarny i hydrofobowy koniec oraz polarny, hydrofilowy koniec. Włożone do wody gromadzą
się same tak, że hydrofilowe końce kierują się ku wodzie, a hydrofobowe są
odsunięte, unikając kontaktu z wodą. To dlatego olej nie miesza się z wodą.
Natomiast alkohol i woda mieszają się tak łatwo, że nie potrzeba ich mieszać;
oba są płynami polarnymi. Zapomniałem nazwiska króla, który powiedział: „Nie
interesuje mnie, gdzie płynie woda, jak długo nie dostaje się do mojego wina!"
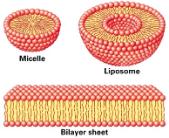
Dzięki oddziaływaniu hydrofobowemu mogą powstać piękne samoporządkujące się (self-assembled) micele, liposomy i warstwy bimolekularne.
8.4 Rozpoznanie molekularne i samoporządkowanie
 Popatrzmy na szczegóły tego, jak zachodzi obniżanie
energii swobodnej na skalę atomową. Jeśli dwa atomy są blisko siebie, zwiążą
się, żeby stworzyć cząsteczkę, jeśli cząsteczka ma niższą energię swobodną niż
te dwa oddzielne atomy. Rozważmy następnie możliwe wiązania między
cząsteczkami, żeby stworzyć jeszcze większe zespoły (lub "zespoły
supramolekularne"). To robi się teraz ciekawsze. Istotne staje się tutaj
ważne pojęcie rozpoznania molekularnego. Taki rodzaj cząsteczek, które
mają pewien stopień komplementarności, będzie z pewnym
prawdopodobieństwem tworzyć zespoły. Mamy dwa rodzaje komplementarności do
rozważenia: kształty „zamka i klucza" oraz komplementarne rozkłady
ładunku (pamiętajmy, dodatni przyciąga ujemny). Jeśli istnieją te
komplementarności, umożliwiają one dwóm cząsteczkom dokładne dopasowanie do
siebie, obniżając w ten sposób ogólną energię potencjalną, a więc energię
swobodną. Jest to bardziej stabilna konfiguracja, ponieważ fluktuacje
temperatury mają mniejszą możliwość rozdzielenia dobrze dopasowanych cząsteczek i to jest istotą samoporządkowania w Naturze. Samoporządkowanie jest jak
wzrost kryształu, tyle tylko, że końcowy produkt może nieść znacznie więcej
informacji, tj. jest bardziej złożony.
Popatrzmy na szczegóły tego, jak zachodzi obniżanie
energii swobodnej na skalę atomową. Jeśli dwa atomy są blisko siebie, zwiążą
się, żeby stworzyć cząsteczkę, jeśli cząsteczka ma niższą energię swobodną niż
te dwa oddzielne atomy. Rozważmy następnie możliwe wiązania między
cząsteczkami, żeby stworzyć jeszcze większe zespoły (lub "zespoły
supramolekularne"). To robi się teraz ciekawsze. Istotne staje się tutaj
ważne pojęcie rozpoznania molekularnego. Taki rodzaj cząsteczek, które
mają pewien stopień komplementarności, będzie z pewnym
prawdopodobieństwem tworzyć zespoły. Mamy dwa rodzaje komplementarności do
rozważenia: kształty „zamka i klucza" oraz komplementarne rozkłady
ładunku (pamiętajmy, dodatni przyciąga ujemny). Jeśli istnieją te
komplementarności, umożliwiają one dwóm cząsteczkom dokładne dopasowanie do
siebie, obniżając w ten sposób ogólną energię potencjalną, a więc energię
swobodną. Jest to bardziej stabilna konfiguracja, ponieważ fluktuacje
temperatury mają mniejszą możliwość rozdzielenia dobrze dopasowanych cząsteczek i to jest istotą samoporządkowania w Naturze. Samoporządkowanie jest jak
wzrost kryształu, tyle tylko, że końcowy produkt może nieść znacznie więcej
informacji, tj. jest bardziej złożony.
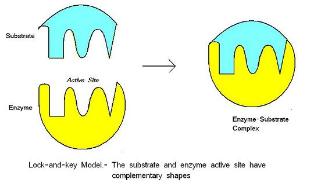 Zjawisko molekularnej komplementarności odkrył
laureat Nagrody Nobla Paul Ehrlich. Jako student pracował z nowoodkrytymi
barwnikami anilinowymi, których używał do barwienia komórek biologicznych.
Stwierdził, że każdy barwnik barwił tylko określony typ tkanki albo określony
gatunek bakterii, ale nie inne. Cząsteczki barwnika krążą w roztworze aż znajdą
miejsce wiążące, dokładnie pasujące do wzoru atomów w jednym z jego
bocznych łańcuchów. Dla stabilności komplementarność „zamka" i „klucza" nie
powinna być tylko przestrzenna, ale także elektrostatyczna; inaczej
specyficzność nie jest bardzo mocna. Nie tylko dwa kształty powinny być
komplementarne, także regiony nadmiarowego ładunku dodatniego na jednej
cząsteczce powinny być komplementarne do regionów nadmiarowego ładunku ujemnego
na drugiej. Poniżej podaję kilka przykładów przestrzennej i ładunkowej
komplementarności w Naturze:
Zjawisko molekularnej komplementarności odkrył
laureat Nagrody Nobla Paul Ehrlich. Jako student pracował z nowoodkrytymi
barwnikami anilinowymi, których używał do barwienia komórek biologicznych.
Stwierdził, że każdy barwnik barwił tylko określony typ tkanki albo określony
gatunek bakterii, ale nie inne. Cząsteczki barwnika krążą w roztworze aż znajdą
miejsce wiążące, dokładnie pasujące do wzoru atomów w jednym z jego
bocznych łańcuchów. Dla stabilności komplementarność „zamka" i „klucza" nie
powinna być tylko przestrzenna, ale także elektrostatyczna; inaczej
specyficzność nie jest bardzo mocna. Nie tylko dwa kształty powinny być
komplementarne, także regiony nadmiarowego ładunku dodatniego na jednej
cząsteczce powinny być komplementarne do regionów nadmiarowego ładunku ujemnego
na drugiej. Poniżej podaję kilka przykładów przestrzennej i ładunkowej
komplementarności w Naturze:
·
Komplementarność między aktywnym miejscem w enzymie i substratem enzymu.
·
Dobrze znana „komplementarność par zasad" w DNA (kwas deoksyrybonukleinowy) i RNA (kwas rybonukleinowy). [Omówię to później].
·
Samoporządkowanie wirusów i organelli wewnątrzkomórkowych.
·
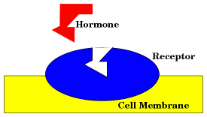
Receptory ulokowane na powierzchni komórek wiążą tylko bardzo ograniczoną liczbę
substratów (często tylko jeden). Receptor jest zwykle znacznie bardziej złożony
(większy) niż substrat (hormon), który się z nim wiąże, jak wskazuje załączony
szkic.
 Zespoły supramolekularne, tworzące się normalnie w niemal zwykłych warunkach, zazwyczaj nie wymagają oddziaływania kowalentnego.
Zamiast tego rządzą nimi słabe, tj. niekowalentne lub drugorzędne
oddziaływania (van der Waalsa; słabe Coulomba; wiązanie wodorowe; hydrofobowe
itd.). Ze względu na tę cechę wiązania w zespołach supramolekularnych w temperaturze pokojowej lub jej bliskiej mogą zostać z łatwością rozrywane i przekształcane w sposób dający się odwrócić w czasie, aż cały układ znajdzie
najbardziej stabilną konfigurację. Odwracalność wiązania jest bardzo ważną cechą
samoporządkowania się przez rozpoznawanie molekularne.
Zespoły supramolekularne, tworzące się normalnie w niemal zwykłych warunkach, zazwyczaj nie wymagają oddziaływania kowalentnego.
Zamiast tego rządzą nimi słabe, tj. niekowalentne lub drugorzędne
oddziaływania (van der Waalsa; słabe Coulomba; wiązanie wodorowe; hydrofobowe
itd.). Ze względu na tę cechę wiązania w zespołach supramolekularnych w temperaturze pokojowej lub jej bliskiej mogą zostać z łatwością rozrywane i przekształcane w sposób dający się odwrócić w czasie, aż cały układ znajdzie
najbardziej stabilną konfigurację. Odwracalność wiązania jest bardzo ważną cechą
samoporządkowania się przez rozpoznawanie molekularne.
Materiały biologiczne i inne miękkie materiały mogą samo porządkować się w rozmaite kształty i w szeroki wachlarz skal długości. Zazwyczaj jest tam trochę wody, a najważniejszym czynnikiem pośredniczącym w samoporządkowaniu jest oddziaływanie hydrofobowe. Nawiasem mówiąc, samoporządkowanie per se jest znacznie bardziej powszechnym zjawiskiem niż tylko samoporządkowanie molekularne. Oto niektóre przykłady: kolonie bakterii; ule; mrowiska; ławice ryb; wzory pogodowe; także galaktyki.
Samoporządkowanie może być albo statyczne, albo dynamiczne. To pierwsze zachodzi w układach, które są w stanie lokalnej lub globalnej równowagi i które nie rozpraszają energii (np. kryształy). Dynamiczne samoporządkowanie jest istotniejsze z punktu widzenia ewolucji złożoności i zawsze obejmuje rozpraszanie energii. Oto niektóre przykłady: reakcje oscylujące i dyfuzyjne; wzory pogody; galaktyki.
Słabe oddziaływania z energiami porównywalnymi do energii temperaturowych zapewniają, że wiązania mogą tworzyć się i rozpadać aż osiągnięta zostanie uporządkowana konfiguracja o najniższej energii.
Wzrost kryształów molekularnych jest tego przykładem. Odwracalność implikuje także, że powstający (samoporządkujący się) układ jest przez cały czas bliski stanu równowagi.
8.5 Ewolucyjne projektowanie leków
 Jako małą dygresję chcę tutaj wspomnieć użycie idei
„zamka i klucza" do tworzenia leków. Bardzo często, żeby lek był skuteczny, jego
struktura molekularna powinna być taka, by dokładnie pasował w odpowiednią
szczelinę w cząsteczce białka. Bardziej ogólnie, działanie leku osiąga się przez
wiązanie jednej cząsteczki tj. „liganda" do kieszonki drugiej, zazwyczaj
większej cząsteczki — receptora. W swojej wiążącej konformacji cząsteczki
wykazują komplementarność geometryczną i chemiczną, a obie są niezbędne, by lek
działał.
Jako małą dygresję chcę tutaj wspomnieć użycie idei
„zamka i klucza" do tworzenia leków. Bardzo często, żeby lek był skuteczny, jego
struktura molekularna powinna być taka, by dokładnie pasował w odpowiednią
szczelinę w cząsteczce białka. Bardziej ogólnie, działanie leku osiąga się przez
wiązanie jednej cząsteczki tj. „liganda" do kieszonki drugiej, zazwyczaj
większej cząsteczki — receptora. W swojej wiążącej konformacji cząsteczki
wykazują komplementarność geometryczną i chemiczną, a obie są niezbędne, by lek
działał.
Syntetyzowanie wszystkich tych próbnych leków i testowanie ich zgodności z szczeliną w cząsteczce białka potrafi być bardzo kosztowne. Dlatego też używa się komputerów do przeprowadzania tak zwanego "ewolucyjnego obliczania". Kody komputerowe generują losowo cząsteczki leku, które testują wobec szczeliny w białku. Jedna taka wyobrażona cząsteczka może zawierać miejsce, które pasuje do jednego z, powiedzmy, sześciu miejsc w szczelinie. Ta cząsteczka zostaje „dobrana" (daje „korzyść ewolucyjną") i tworzy się miliard jej odmian, po czym testuje je odpowiednim „testem dostosowania". Kontynuuje się to w następnym pokoleniu próbnych cząsteczek aż osiągnie się najlepszy kształt leku. W kolejnym artykule, po wprowadzeniu podstaw ewolucji biologicznej, omówię taką „sztuczną ewolucję". Jak powiedział Kevin Kelly (1994): „Ewolucyjne hodowanie leków jest przyszłością biotechnologii".
8.6 Wirus mozaiki tytoniowej
 Rozważam tutaj przykład wirusa mozaiki tytoniowej (TMV),
żeby zilustrować mglistą, być może nieistniejącą, linię między życiem i nie-życiem. Każdy wirus (włącznie z TMV) ma typowo trzon z RNA i otoczkę z białka. Można rozdzielić te dwa składniki, oczyścić je i zmagazynować w laboratorium. W dowolnym późniejszym czasie można zmieszać i inkubować te
składniki i TMV zrekonstruuje się przez samoporządkowanie. Zrekonstruowany TMV
nie tylko powraca do „życia", ale może także rozmnażać się, jeśli umieści się go
na liściu tytoniu!
Rozważam tutaj przykład wirusa mozaiki tytoniowej (TMV),
żeby zilustrować mglistą, być może nieistniejącą, linię między życiem i nie-życiem. Każdy wirus (włącznie z TMV) ma typowo trzon z RNA i otoczkę z białka. Można rozdzielić te dwa składniki, oczyścić je i zmagazynować w laboratorium. W dowolnym późniejszym czasie można zmieszać i inkubować te
składniki i TMV zrekonstruuje się przez samoporządkowanie. Zrekonstruowany TMV
nie tylko powraca do „życia", ale może także rozmnażać się, jeśli umieści się go
na liściu tytoniu!
8.7 Zawdzięczamy życie wiązaniu wodorowemu
Życie i jego ewolucja zależą od wiązania wodorowego. To wiązanie jest znacznie słabsze niż wiązanie kowalentne, niemniej wystarczająco silne, by podtrzymać samoporzadkujące się struktury biologiczne, umożliwiając im wytrzymanie niszczących wpływów fluktuacji temperaturowych i innych zakłóceń. Wiązanie wodorowe i związane z nim oddziaływanie hydrofobowe ma właściwy rodzaj siły, by umożliwić samoporządkowanie się superstruktur bez potrzeby nieodwracalnych reakcji chemicznych. Istnieje silny element odwracalności związany z tymi słabymi oddziaływaniami, które umożliwiają spontaniczne tworzenie i rozłamywanie zespołów, aż osiągną konfigurację o najniższej energii swobodnej.
8.8 Samoorganizacja
Ilość informacji zawarta w zorganizowanej lub złożonej materii jest bardzo wysoka. Ta informacja rozkłada się w kształtach cząsteczek składowych i we wzorach interakcji między nimi. Nagromadzanie się tej informacji wymaga serii kolejnych etapów: rozpoznanie molekularne; samoporządkowanie; samoorganizacja (self-organisation); adaptacja chemiczna i ewolucja. Już rozważaliśmy dwie pierwsze. Skupmy się teraz na samoorganizacji.
Lehn (2002) zdefiniował samoorganizację jako „spontaniczne, ale kierowane informacją tworzenie zorganizowanych, funkcjonalnych struktur w warunkach równowagi". Informacja („kodowanie") niezbędna do samoorganizacji zawarta jest w rozpoznaniu molekularnym i skłonnościach do samoporządkowania cząstek składowych. To kodowanie określa także jak samoporządkująca się budowla samoorganizuje się w funkcjonalną strukturę w stanie równowagi. W mojej książce Smart Structures: Blurring the Distinction between the Living and the Nonliving (2007) znajduje się przegląd różnych typów kodowania dla samoorganizacji.
Samoorganizacja jest zjawiskiem znacznie bardziej wszechobecnym niż tylko coś, co dzieje się na poziomie molekularnym. Oto kilka przykładów:
·
Laser jest samozorganizowanym systemem. We właściwie skonstruowanych warunkach
fotony spontanicznie grupują się w konfigurację, w której wszystkie poruszają
się w fazie, czego wynikiem jest potężna wiązka laserowa.
·
Huragan jest samozorganizowanym systemem. Stały przypływ energii ze Słońca,
ciągnie wodę z oceanów, jak również napędza wiatr. Łagodne wiatry tropikalne
mogą wyrosnąć w zorganizowaną konfigurację huraganu, kiedy przekraczają pewien
krytyczny próg.
·
Żywa komórka jest samozorganizowanym systemem, który organizuje się cały czas,
zależnie od środowiska.
·
Gospodarka jest samoorganizującym się systemem. Popyt na dobra i usługi, jak
również popyt na siłę roboczą nieustannie organizuje gospodarkę w spontaniczny
sposób bez żadnej kontrolującej władzy centralnej.
8.9 Adaptacja chemiczna i ewolucja
Przy danym zestawie warunków cząsteczki w układzie mają tendencję do samoorganizowania się tak, by zminimalizować ogólną energię swobodną. To jest adaptacja chemiczna. Załóżmy teraz, że ten zestaw warunków zmienia się. Jest to bardzo prawdopodobne, właściwie nieuniknione, bo mamy do czynienia z otwartym systemem. Musi nastąpić kolejna runda samoorganizacji, jak zawsze rządzona przez drugą zasadę termodynamiki. To jest chemiczna ewolucja. Ponadto zestaw zmieniających się warunków, tj. zmieniające się środowiska, jakiego doświadczają cząsteczki, niekoniecznie musi być zewnętrzne dla zestawu cząsteczek. Także wewnętrzne zmiany w systemie molekularnym stanowią zmienione środowisko dla każdego członka tego zestawu. A konfiguracje molekularne zmieniają się bez przerwy. Tak więc, adaptacja i ewolucja chemiczna zdarza się w otwartym systemie cząsteczek (włącznie z naszym ekosystemem) przez cały czas.
Można szukać analogii z ewolucją darwinowską, żeby zobaczyć, czy „dobór naturalny" (tj. selekcja molekularna) i „przetrwanie najlepiej przystosowanych" zdarzają się także w ewolucji chemicznej. Odpowiedź brzmi „tak", ponieważ kiedy zasoby są ograniczone, istnieje konkurencja między alternatywnymi ścieżkami molekularnych reakcji i tylko najlepiej przystosowane ścieżki mogą przetrwać, jeśli chodzi o konsumpcję cząsteczek prekursorowych i bogatych w energię. Takie rozważania wzbudziły specjalne zainteresowanie pochodzeniem cząsteczek podtrzymujących życie. Pionierską pracę w tym kierunku wykonał Melvin Calvin (1969), który wprowadził koncepcję autokatalizy jako mechanizmu doboru molekularnego. Będę omawiał autokatalizę w następnym artykule.
8.10 Uwagi końcowe
Idea zamka i klucza jest zasadnicza dla wyjaśnienia ewolucji w Naturze cząsteczek i zespołów molekularnych o wzrastającej złożoności. Dwie cząsteczki mogą normalnie oddziaływać na siebie tylko w słaby sposób, ale dokładne dopasowanie części tych dwóch cząsteczek do siebie może prowadzić do znacznie silniejszego stopnia spoistości (kohezji) między nimi, ponieważ „dotykają się" lub przyciągają wzajemnie w wielu punktach.
Innym zasadniczym czynnikiem w chemicznej ewolucji złożoności jest odwracalność niekowalentnych wiązań między cząsteczkami; odwracalność jest kluczem do samoporządkowania. A kiedy już powstaną stabilne samo uporządkowane układy (dzięki molekularnym próbom i błędom), na ogół nie ma odwrotu. Ogólna duża spoistość energii daje stabilizujący efekt. Jeśli jednak środowisko zmienia się, samouporządkowany system może zareagować (tj. przystosować się, zaadaptować) wykorzystując znowu odwracalną naturę swoich niekowalentnych interakcji. To jest ewolucja chemiczna. Jak zobaczymy z czasem, ewolucja chemiczna prowadzi do ewolucji biologicznej. A jak powiedziałem już wiele razy, ewolucja i właściwości emergentne są znamionami złożoności.
Zakończę kilkoma słowami o pęcherzykach, które dostarczają dobrego, wręcz dramatycznego przykładu samoorganizacji w nieżywy złożony układ. Pęcherzyki są kulistymi supramolekularnymi zespołami, oddzielającymi płynną zawartość wnętrza od zewnętrznego rozpuszczalnika lipidową warstwą dwucząsteczkową. Są także nazywane liposomami i są dość podobne do miceli (patrz rysunek powyżej). W odpowiednich warunkach lipidy mogą samoporzadkować się w olbrzymie pęcherzyki wielkości komórek biologicznych. Podstawową siła napędową tego samoporządkowania jest oddziaływanie hydrofobowe. Jak to żywo opisali Menger i Gabrielson (1995) pęcherzyki pod wieloma względami potrafią naśladować żywe komórki, chociaż żywe nie są:
Kiedy olbrzymi pęcherzyk, który przypadkiem ma w środku mniejsze pęcherzyki, zostaje wystawiony na działanie glukozydu oktylu, mniejsze pęcherzyki mogą przeniknąć przez błonę zewnętrzną do otaczającego środowiska („narodziny"). Wynikające z tego uszkodzenie błony pęcherzyka-gospodarza zrasta się natychmiast. Z drugiej strony, dodanie kwasu cholowego powoduje szaleństwo pochłaniania, w którym pęcherzyk rośnie szybko w miarę konsumowania swoim mniejszych sąsiadów. Kiedy nie ma więcej żywności, olbrzymi pęcherzyk ulega samozniszczeniu (przypadek „narodzin, wzrostu i śmierci"). Takie podobne do życia zmiany morfologiczne uzyskuje się dzięki użyciu dostępnych w handlu substancji chemicznych; tak więc te procesy powinny być przypisane chemii organicznej, nie zaś biologii czy nawet biochemii.
Od tłumaczki: Niestety nie miałam możliwości skonsultowania tłumaczenia tego tekstu z żadnym polskim chemikiem, przekazuję go zatem do publikacji z nadzieją, iż kompetentni czytelnicy szybko zauważą ewentualne błędy i pomogą je skorygować.
Nirmukta, 29 października 2009r.
Vinod K. Wadhawan Induski emerytowany fizyk atomowy, współwydawca portalu PHASE TRANSITIONS, publicysta, autor wielu książek. Induski emerytowany fizyk atomowy, współwydawca portalu PHASE TRANSITIONS, publicysta, autor wielu książek. Liczba tekstów na portalu: 20 Pokaż inne teksty autora |
Oryginał.. (http://www.racjonalista.pl/kk.php/s,6976)
(Ostatnia zmiana: 01-12-2009)