 | | 1. Dr Roman Luboradzki z Instytutu Chemii Fizycznej PAN przy
dyfraktometrze rentgenowskim wykorzystywanym w badaniu struktury
krystalicznej kserożeli. (Źródło: IChF PAN, Grzegorz Krzyżewski) |
W jaki sposób jedna cząsteczka substancji żelującej potrafi
unieruchomić nawet kilka tysięcy cząsteczek rozpuszczalnika? Poznanie
mechanizmu odpowiedzialnego za żelowanie może otworzyć drogę do
opracowania nowych materiałów oraz bezpieczniejszych sposobów transportu
cieczy groźnych dla otoczenia. Struktura żeli jest jednak trudna do
bezpośredniego badania, co udowadniają eksperymenty przeprowadzone w
Instytucie Chemii Fizycznej Polskiej Akademii Nauk w Warszawie.
U wejścia do portu dochodzi do zderzenia dwóch tankowców wypełnionych
ropą. Czy gigantyczna katastrofa ekologiczna jest nieunikniona? Dziś
najbardziej prawdopodobna odpowiedź brzmi: tak. W przyszłości efektem
zderzenia może być tylko pogięty metal. Ropa nie wypłynie, ponieważ
wewnątrz zbiornika będzie miała postać żelu.
"Transport niebezpiecznych cieczy w formie zżelowanej to obecnie
fantazja. Nie można jednak wykluczyć, że w przyszłości uda się opracować
związki żelujące, które pozwolą zwiększyć bezpieczeństwo. Ale aby to się
stało, musimy najpierw dokładnie poznać wewnętrzną strukturę żeli oraz
mechanizmy rządzące ich powstawaniem", mówi dr Roman Luboradzki z IChF
PAN.
Żele to układy przypominające wyglądem mniej lub bardziej sprężystą
galeretę. Zazwyczaj są dwuskładnikowe: jeden składnik pełni rolę
rozpuszczalnika, drugi - czynnika żelującego. W procesie żelowania
(polegającym na schłodzeniu ciekłej mieszaniny obu składników) czynnik
żelujący tworzy w przestrzeni żelu rozległą sieć, która unieruchamia
rozpuszczalnik. Sieć najczęściej składa się z amorficznych struktur
przypominających nitki lub tasiemki, rzadziej są to stykające się
konstrukcje sferyczne.
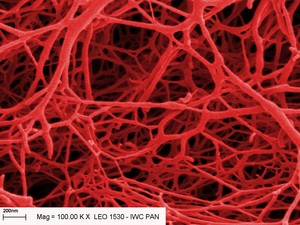 | | 2. Amorficzna struktura kserożelu na zdjęciu ze skaningowego mikroskopu
elektronowego. Kolory sztuczne. (Źródło: IChF PAN) |
W żelach chemicznych cząsteczki czynnika żelującego łączą się ze sobą
za pomocą silnych wiązań kowalencyjnych i tworzą bardzo sztywne i trwałe
struktury. Żele fizyczne, badane w IChF PAN, powstają na odmiennej
zasadzie. Czynnik żelujący, którym zwykle jest jakaś substancja
organiczna, zawiera małe cząsteczki, liczące od kilkunastu do
kilkudziesięciu atomów (stąd nazwa: Low Molecular Mass Organic Gelators,
LMOG). Cząsteczki te łączą się w długie struktury oddziałując ze sobą za
pomocą słabych oddziaływań, takich jak wiązania wodorowe, oddziaływania
pi-pi, siły van der Waalsa itp. Przejście żelu fizycznego w ciecz i
cieczy w żel to procesy odwracalne. Zwykle zachodzą bardzo szybko, przy
zmianie temperatury o zaledwie 1-2 stopnie w pobliżu wartości
krytycznej.
Analizowanie struktury żeli, zwłaszcza typu LMOG, jest trudnym
zadaniem. Oba składniki żelu często charakteryzują się zbliżoną
przezroczystością, a szczegóły struktury sieci mają rozmiary rzędu co
najwyżej kilkunastu-kilkudziesięciu nanometrów. Żelu o takiej budowie
nie można obejrzeć pod mikroskopem optycznym. Skaningowa mikroskopia
elektronowa (SEM) wymaga natomiast umieszczenia próbki w próżni. Wymóg
ten oznacza, że żel należy najpierw odpowiedno przygotować do badań.
Aby zagwarantować zachowanie struktury czynnika żelującego pod
mikroskopem SEM, naukowcy stosują dwie metody. Pierwsza polega na
umieszczeniu próbki żelu w pompie próżniowej. W obniżonym ciśnieniu
rozpuszczalnik szybko paruje, pozostawiając utrwalony czynnik żelujący,
zwykle wyglądający jak biały puder. Tak powstała struktura jest nazywana
kserożelem. Kserożele otrzymuje się również z użyciem sublimacji. W tym
przypadku próbkę zamraża się w ciekłym azocie. Zakłada się przy tym, że
proces zamrażania próbki przebiega tak szybko, że struktura sieci
tworzonej przez czynnik żelujący się nie zmienia. Zamrożona próbka
trafia następnie do komory próżniowej, gdzie rozpuszczalnik stopniowo
sublimuje.
 | | 3. Zmiany zachodzące w jednym z kserożeli wraz ze wzrostem temperatury.
Widać gwałtowne formowanie struktur krystalicznych i bardzo szybkie
przejście w stan ciekły. Temperatura między pierwszą a ostatnią klatką
zmieniła się o 96 stopni Celsjusza. (Źródło: IChF PAN) |
"Problem w tym, że na niektórych obrazach z mikroskopu SEM widać
kryształy w kserożelach, w których teoretycznie być ich nie powinno. Nie
wiedzieliśmy, czy kryształy te są rzeczywistą częścią struktury żelu,
czy skutkiem procedury przygotowywania próbki do badań mikroskopowych.
Dlatego postanowiliśmy sprawdzić, jak zmienia się struktura kserożelu
pod wpływem czasu i w zależności od sposobu przygotowywania próbek dla
mikroskopu", mówi dr Luboradzki.
Wyniki otrzymane w Instytucie Chemii Fizycznej PAN wskazują, że nie
zawsze to, co widać pod skaningowym mikroskopem elektronowym, odpowiada
pierwotnej strukturze czynnika żelującego w żelu.
Niezbędnym etapem przygotowania próbki do badania pod mikroskopem SEM
jest napylenie na nią warstwy przewodzącej. Ponieważ proces wiąże się z
lokalnym podgrzewaniem próbki, obawiano się, że może prowadzić do zmian
struktury kserożelu. Testy napylania węglem, platyną, złotem i palladem
wykazały jednak, że napylanie nie wpływa na morfologię kserożelu.
Jednocześnie udało się zauważyć, że struktura niektórych kserożeli
zależała od objętości próbki, a nawet od kształtu naczynia z próbką.
Kserożele przygotowane w standardowej butelce zawierały więcej struktur
krystalicznych niż próbki o dziesięciokrotnie mniejszej objętości
umieszczone w kapilarach. Zaobserwowano także, że przemianę amorficznych
nitek gotowego kserożelu w formę krystaliczną można przyspieszyć lekko
podgrzewając próbkę. Co więcej, niektóre kserożele zaczynały samoistnie
krystalizować po upływie kilku miesięcy. Oznacza to, że nawet poprawnie
przygotowana próbka kserożelu nim trafi pod mikroskop SEM może w istotny
sposób zmienić swoją strukturę.
"Kserożele nie grają z naukowcami czysto - przynajmniej niektóre
próbują nas oszukiwać. Teraz, gdy o tym wiemy, będziemy mogli uniknąć
wielu błędów interpretacyjnych i szybciej rozwiązać zagadkę, w jaki
sposób jedna mała cząsteczka czynnika żelującego potrafi skutecznie
związać nawet dziesięć tysięcy cząsteczek rozpuszczalnika", mówi dr
Luboradzki. | 

