
|
Nauka » Biologia » Powstanie życia Jak powstało życie? Słowo wstępneZachęcony przez Pana Mariusza Agnosiewicza postanowiłem napisać cykl trzech artykułów o powstaniu życia na Ziemi. Dostępny mi materiał podzieliłem na trzy części: Pierwsza z nich to opis doświadczenia Millera-Ureya, które rozpoczęło rozkwit dziedziny biologii opisującej powstanie życia. Starałem się przekazać posiadaną mi wiedzę w sposób jasny i czytelny. Ponieważ zagadnienie to często jest wykorzystywane w nieuczciwy sposób przez kreacjonistów poprzez zaciemnianie faktów i ukrywanie sukcesów (i jak zwykle zawalanie czytelnika terminami naukowymi, krasomówczą propagandą i rysunkami spod rąk artystów plastyków), opisałem je dość szczegółowo i w większości ze znanych mi wariantów. Wynik doświadczenia i opis powstałych cząsteczek są nawiązaniem do Części drugiej, która przedstawia szeroko akceptowaną teorię świata RNA, jako pierwszego świata biochemicznego. Od powstania, poprzez ewolucje in vitro, po wielorakość rodzajów. Świat pre-RNA. W artykule znajdzie się również informacja o konkurencyjnych teoriach: świat DNA, świat białek. Do kompletu potrzebna byłaby jedynie Część trzecia, która opisuje powstanie pierwszych błon — prekursorów komórek, możliwości uwięzienia w nich systemów biochemicznych, co najwyraźniej prowadzi nas do powstania życia pełną, bakteryjną gębą. Mam nadzieję, że moje artykuły spotkają się z pozytywnym, ale także i krytycznym odbiorem, co może zaowocuje ciekawymi dyskusjami na Forum Racjonalisty. Jestem gotów na odparcie wszelkich zarzutów i rozpatrzenie komentarzy. Jak powstało życie?Około trzy i pół miliarda lat temu młoda Ziemia nie wydawała się zbyt przyjazna życiu. Bezkresne oceany prebiotycznego roztworu, brak tlenu, powierzchnia bezlitośnie chłostana promieniami ultrafioletowymi jałowiącymi wszystko, czego dosięgły. Amoniak, metan, wodór i woda to prawdopodobnie główne składniki redukcyjnej atmo- i hydrosfery — nijak obiecujące powstanie tak niesamowitego tworu jakim jest życie. Jednak dzięki wyładowaniom elektrycznym w prabulionie zaczęły powstawać specyficzne cząsteczki organiczne — najważniejsze z nich to aminokwasy będące podstawowym składnikiem białek budujących nasze tkanki oraz pirymidyny i puryny — zasady azotowe wchodzące w skład łańcuchów RNA i DNA — najważniejszych nośników informacji w świecie ożywionym. Wyładowania elektryczne wciąż powodowały syntezę związków na całej powierzchni Ziemi, najwyraźniej z dobrym skutkiem — trzy i pół miliarda lat później młody student przyglądał się podobnym — sztucznie indukowanym wyładowaniom w kolbie wypełnionej metanem, amoniakiem i wodorem. Doświadczenie Millera-UreyaWyniki doświadczenia okazały się bardzo obiecujące, część świata naukowego podważała wiarygodność doświadczenia sugerując zanieczyszczenie bakteryjne, jednak wkrótce rozwiano wszelkie wątpliwości — aparatura użyta do doświadczenia była sterylizowana znacznie dłużej niż to jest wymagane. Należy pamiętać, że skład preatmosfery jest oparty na pewnych założeniach. Spekuluje się również, iż duży odsetek stanowił CO2, produkowany przez wulkany, w którego obecność (zamieniając z metanem) rezultaty eksperymentów prebiotycznych nie są już tak imponujące. Nikt jednak nie wykluczy nieobecności metanu w atmosferze młodej Ziemi. Idea redukującej atmosfery ukazała się po raz pierwszy w latach dwudziestych ubiegłego wieku w opracowaniu rosyjskiego naukowca Oparina. Zakładał on, że pierwsze prymitywne organizmy musiały być heterotroficzne (czerpiące źródło energii z zewnątrz, lecz jej nie wytwarzające), podążając za znaną zasadą: im mniej biosyntezy, tym mniejszy stopień komplikacji. Zakładamy oczywiście, że najpierw powstały organizmy mniej skomplikowane. Dlatego najbardziej prawdopodobna jest atmosfera redukująca, jako warunki wyjściowe do powstania składników organicznych. Co ciekawe, używając otrzymane mieszaniny, poddawano je dalszym eksperymentom symulującym warunki panujące na „lagunach" — z prostych związków powstał kwas pantotenowy, związek ściśle skorelowany z koenzymem A, kluczowym elementem systemu formowania białek i cykli metabolicznych [ 2 ]. Co ciekawe, inny minerał skalny potrafi katalizować łączenie się aminokwasów w łańcuchy peptydowe. [ 5 ] Nie są to jeszcze aktywne białka, ale coś na podobieństwo krótkich ich fragmentów. Czyż to wyraźnie nie wskazuje na względnie dużą szansę na powstanie zalążków życia z prostych substancji i skał? Skoro już jesteśmy przy aminokwasach — w doświadczeniach prebiotycznych pojawił się jeszcze jeden problem. Jak okazało się, mieszanina aminokwasów była racemiczna, czyli występowały w niej po równo izoformy D i L (formy te posiadają różną zdolność do skręcania płaszczyzny polaryzacji swiatła). Należy tu wspomnieć, że również racemiczną reprezentację cząstek znalezionych w meteorycie z Murchison. Nota bene, inny wynik tego doświadczenia wskazywałby na zanieczyszczenie bakteryjne.
Czy świat powstały ze szczęścia i przypadku w świetle powyższych faktów wydaje się niemożliwy? Niepotrzebne jest tu żonglowanie statystyką, wymysły o czarnych i białych kulkach w worku, gdyż tak naprawdę żaden kreacjonista nie jest w stanie wymyślić wzoru na życie. Jeśli uzmysłowimy sobie, że szansa na powstanie aktywnych cząsteczek życia była niemal równa, (dodajmy nawet: niewielka), w każdej kropli na całym obszarze ziemskim, to czyż biadolenie o wygranej na loterii nie wydaje się bezpodstawnym i nieracjonalnym bełkotem? Czy nie lepiej cieszyć się dotychczasowymi sukcesami? O wiele ciekawiej jest zadawać sobie pytania: jak to mogło być; wypełniać te luki w naszej niewiedzy i tworzyć kompletną teorię powstania życia, początków początku, nas samych. Wiem, że dużo łatwiejsze dla wielu będzie wpychanie w tę lukę kreatora z jego magiczną różdżką, ale jeśli tak łatwe miałoby być nasze poznawanie, życie byłoby najnudniejszym tworem, jaki powstał. * Literatura — podstawowe wiadomości oraz tło historyczne: „From Primordial Soup to the Prebiotic Beach" An interview with exobiology pioneer, Dr. Stanley L. Miller, University of California San Diego, by Sean Henahan, Acccess Excellence. 1996.
Przypisy: [ 1 ] Michael P. Robertson & Stanley L. Miller, „An efficient prebiotic
synthesis of cytosine and uracil", Nature 375, 772-774 (1995). [ 2 ] Anthony D. Keefe, Gerald L. Newton & Stanley L.
Miller, "A possible
prebiotic synthesis of pantetheine, a precursor to coenzyme A", Nature
373,683-685 (1995). [ 3 ] Zubay G., „Studies on the lead-catalyzed synthesis of aldopentoses.",
Orig. Life Evol. Biosph. 1998 Reb;28(1):13:26. [ 10 ] Ponnamperuma C., Sagan C., Mariner R., „Synthesis of adenosine triphosphate under possible primitive Earth conditions", Nature 1963 Vol. 199: 222-225. [ 11 ] Ponnamperuma C., Mack R., „Nucleotide synthesis under possible primitive Earth conditions", Science 1965 Vol. 148: 1221-3. [ 4 ] James P. Ferris „Montmorillonite catalysis of RNA oligomer formation in
aqueous solution. A model for the prebiotic formation of RNA." Journal of the American Chemical Society. 1993, 155, 12270-12275. [ 5 ] Special feature Part one; Origins of life by Philip
Ball. Nature News. 22
April 1999. [ 6 ] John Mitchell, James Smith. „D-amino acid residues in peptides and
proteins", Proteins: Structure, Function,
and Genetics bol 50, Issue 4, 2003, pages: 563-571 [ 7 ] YokoyamaT, Kan-no N, Ogata T, Kotaki Y, Sato M, Nagahisha E.,
„Presence
of free D-amono acids in microalgae", Biosci.
Biotechnol. Biochem. 2003, Feb; 67(2):388-92. [ 8 ] Balasubramanian R, Seetharamulu P., „Origins of life: conformational
energy calculations on primitive tRNA nestling an amino acid.", Journal
of Theoretical Biology, 1985 Mar 7;113(1):15-28. [ 9 ] Lim K, Tempczyk A, Bonander N, Toedt J, Howard A, Eisentstien E, Herzberg
O. „A catalytic mechanism for D-Tyr-tRNA Tyr deacylase based on the crystal
structure of Hemophilus influaenzae HI0670.", J.
Biol. Chem. 2003 Apr 11;278(15):13496-502. « Powstanie życia (Publikacja: 20-11-2003 Ostatnia zmiana: 30-01-2011)
str. 3065 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [ Regulamin publikacji ] [ Bannery ] [ Mapa portalu ] [ Reklama ] [ Sklep ] [ Zarejestruj się ] [ Kontakt ] Racjonalista © Copyright 2000-2018 (e-mail: redakcja | administrator) | ||




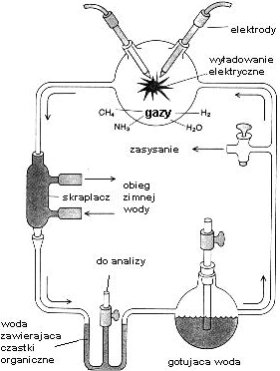 Tym studentem był Stanley L. Miller,
pracujący w laboratorium Harolda C. Ureya na Uniwersytecie Chicagowskim. Dzięki
determinacji młodego człowieka, doświadczenia te doszły do skutku, gdyż Urey
miał wiele wątpliwości co do ich wyniku. Miller po raz pierwszy przeprowadził
syntezę w wczesnych latach 50-tych dwudziestego wieku. (Patrz rysunek) Dolna
kolba symulowała podgrzewany „ocean" parujący poprzez obieg i tworzący
„atmosferę" zawierającą metan, amoniak i wodór w górnej kolbie. Tam też
mieszanina gazów była poddawana działaniu prądu elektrycznego umożliwiając
zachodzenie reakcji. Rozpuszczalne w wodzie produkty symulowanych procesów
prebiotycznych były następnie skraplane i poddane analizie. Eksperyment okazał
się zaskakująco wydajny — naukowcy spodziewali się jedynie śladów
prymitywnego świata biochemicznego — uzyskali zaś 13 aminokwasów (z
dwudziestu budujących białka w żywych organizmach) oraz pirymidyny i puryny
(składniki łańcuchów RNA i DNA). Dwa ostatnie składniki okazały się
niestabilne w pierwszych eksperymentach, co wzbudziło później wiele wątpliwości
co do wysuniętej teorii o pionierskiej roli kwasów nukleinowych. Wartym
wspomnienia jest fakt, że ten sam zestaw molekuł został znaleziony w meteorycie z Murchison, życie więc mogło powstawać w podobny sposób w dalekich nam częściach Wszechświata. Prawdopodobnie Ziemia to jedno z bardzo
rzadkich w nim miejsc sprzyjających ekspansji życia.
Tym studentem był Stanley L. Miller,
pracujący w laboratorium Harolda C. Ureya na Uniwersytecie Chicagowskim. Dzięki
determinacji młodego człowieka, doświadczenia te doszły do skutku, gdyż Urey
miał wiele wątpliwości co do ich wyniku. Miller po raz pierwszy przeprowadził
syntezę w wczesnych latach 50-tych dwudziestego wieku. (Patrz rysunek) Dolna
kolba symulowała podgrzewany „ocean" parujący poprzez obieg i tworzący
„atmosferę" zawierającą metan, amoniak i wodór w górnej kolbie. Tam też
mieszanina gazów była poddawana działaniu prądu elektrycznego umożliwiając
zachodzenie reakcji. Rozpuszczalne w wodzie produkty symulowanych procesów
prebiotycznych były następnie skraplane i poddane analizie. Eksperyment okazał
się zaskakująco wydajny — naukowcy spodziewali się jedynie śladów
prymitywnego świata biochemicznego — uzyskali zaś 13 aminokwasów (z
dwudziestu budujących białka w żywych organizmach) oraz pirymidyny i puryny
(składniki łańcuchów RNA i DNA). Dwa ostatnie składniki okazały się
niestabilne w pierwszych eksperymentach, co wzbudziło później wiele wątpliwości
co do wysuniętej teorii o pionierskiej roli kwasów nukleinowych. Wartym
wspomnienia jest fakt, że ten sam zestaw molekuł został znaleziony w meteorycie z Murchison, życie więc mogło powstawać w podobny sposób w dalekich nam częściach Wszechświata. Prawdopodobnie Ziemia to jedno z bardzo
rzadkich w nim miejsc sprzyjających ekspansji życia.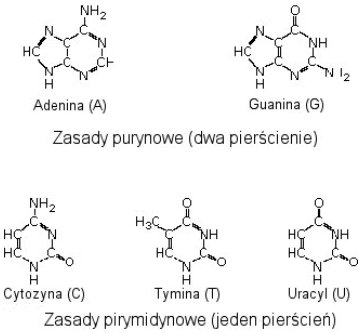 Zupełnie niezrozumiałe jest uporczywe
wskazywanie na labilność powstałych cząsteczek w prawdziwych warunkach
prebiotycznych przez krytyków teorii samorzutnego powstania życia. Zdaję sobie
sprawę, że mieszanina pobierana do analizy w aparacie Millera była schładzana,
lecz łatwo również wyobrazić sobie naturalne warunki — ocean to nie
statyczna zupa, nowopowstałe cząsteczki mogły być np. wmywane pod skały, które
chroniły je przed niszczycielskim promieniowaniem UV. Poza tym, jeśli synteza
przebiegała gwałtownie, przy specyficznych warunkach część cząsteczek mogła
wytrącić się z roztworu (tak jak kożuch na mleku) tworząc przypadkowo
warstwę ochronną dla cząsteczek
znajdujących się poniżej. Ponieważ uzyskanie dużych stężeń cząsteczek,
zwłaszcza pirymidyn, okazało się bardzo trudne, zespół badaczy wyszedł z tak
zwaną 'teorią lagun'. Młoda Ziemia to nie tylko oceany, lecz również
plaże, zagłębienia skalne. Wystarczyło więc zagęścić mieszaninę i podsuszyć — otrzymano imponujące ilości zasad azotowych
Zupełnie niezrozumiałe jest uporczywe
wskazywanie na labilność powstałych cząsteczek w prawdziwych warunkach
prebiotycznych przez krytyków teorii samorzutnego powstania życia. Zdaję sobie
sprawę, że mieszanina pobierana do analizy w aparacie Millera była schładzana,
lecz łatwo również wyobrazić sobie naturalne warunki — ocean to nie
statyczna zupa, nowopowstałe cząsteczki mogły być np. wmywane pod skały, które
chroniły je przed niszczycielskim promieniowaniem UV. Poza tym, jeśli synteza
przebiegała gwałtownie, przy specyficznych warunkach część cząsteczek mogła
wytrącić się z roztworu (tak jak kożuch na mleku) tworząc przypadkowo
warstwę ochronną dla cząsteczek
znajdujących się poniżej. Ponieważ uzyskanie dużych stężeń cząsteczek,
zwłaszcza pirymidyn, okazało się bardzo trudne, zespół badaczy wyszedł z tak
zwaną 'teorią lagun'. Młoda Ziemia to nie tylko oceany, lecz również
plaże, zagłębienia skalne. Wystarczyło więc zagęścić mieszaninę i podsuszyć — otrzymano imponujące ilości zasad azotowych 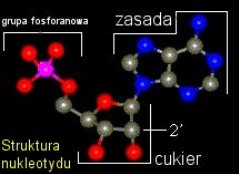 Każdy przyzna, że mieszanina zasad
azotowych nadal nie obiecuje większej, spontanicznej złożoności, mimo, iż
nawet ryboza (cukier wchodzący w skład nukleotydów tworzących RNA) została
uzyskana w eksperymencie prebiotycznym i oczyszczona w obecności związków ołowiu
Każdy przyzna, że mieszanina zasad
azotowych nadal nie obiecuje większej, spontanicznej złożoności, mimo, iż
nawet ryboza (cukier wchodzący w skład nukleotydów tworzących RNA) została
uzyskana w eksperymencie prebiotycznym i oczyszczona w obecności związków ołowiu
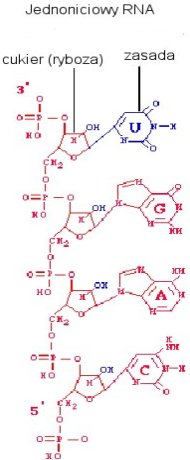 Wiemy, że nukleotydy mogą się
spontanicznie formować w losowe łańcuchy na minerałach. Glin i krzem, wypłukane
ze skał wulkanicznych, formowały warstwową strukturę, z ujemnym ładunkiem między
warstwami. Cecha ta powodowała przyciąganie jonów i tworzenie przez nie
dodatniej warstwy, która zaś była idealnym podłożem do formowania się łańcucha
RNA.
Wiemy, że nukleotydy mogą się
spontanicznie formować w losowe łańcuchy na minerałach. Glin i krzem, wypłukane
ze skał wulkanicznych, formowały warstwową strukturę, z ujemnym ładunkiem między
warstwami. Cecha ta powodowała przyciąganie jonów i tworzenie przez nie
dodatniej warstwy, która zaś była idealnym podłożem do formowania się łańcucha
RNA. 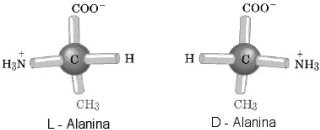 Jak wiemy, świat żywy jest zdecydowanie
zdominowany, z bardzo małymi wyjątkami
Jak wiemy, świat żywy jest zdecydowanie
zdominowany, z bardzo małymi wyjątkami 
 Ukończył biologię molekularną na Uniwersytecie Adama Mickiewicza w Poznaniu. Pracował jako Research Specialist in Health Science w Department of Anatomy and Cell Biology na University of Illinois w Chicago. Obecnie pracuje jako Associate Cell Biologist / Histologist w Abbott Laboratories (Illinois). Specjalizuje się w ekspresji białek 'od zera', hodowlach linii komórkowych, symulacji in vitro procesów zachodzących w komórkach. Jego pasją jest teoria ewolucji, w szczególności ewolucja systemów biochemicznych i pochodzenie życia we Wszechświecie.
Ukończył biologię molekularną na Uniwersytecie Adama Mickiewicza w Poznaniu. Pracował jako Research Specialist in Health Science w Department of Anatomy and Cell Biology na University of Illinois w Chicago. Obecnie pracuje jako Associate Cell Biologist / Histologist w Abbott Laboratories (Illinois). Specjalizuje się w ekspresji białek 'od zera', hodowlach linii komórkowych, symulacji in vitro procesów zachodzących w komórkach. Jego pasją jest teoria ewolucji, w szczególności ewolucja systemów biochemicznych i pochodzenie życia we Wszechświecie.