
|
Nauka » Biologia » Biologia molekularna Epigenetyka Tłumaczenie: Małgorzata Koraszewska i Paweł Koperski Epigenetyka jest badaniem cech dziedzicznych, które nie zależą od pierwotnej sekwencji DNA. To jest krótka, prosta definicja i jest ona także bardzo niezadowalająca. Po pierwsze, włączenie słowa „dziedziczne” wyłącza pewnych istotnych graczy – zróżnicowanie neuronów wymaga wielkich przekształceń epigenetycznych, ale te komórki przeszły ostateczny podział i nigdy więcej się nie podzielą – równocześnie jednak dziedziczność cech, które nie są zdefiniowane przez pierwotne sekwencje, jest prawdopodobnie pierwszą rzeczą, jaka przychodzi na myśl w każdej dyskusji o epigenetyce. Innym problemem jest niewyraźność, elastyczność tej definicji: zasadniczo mieści się w niej wszystko. Regulacja genów, adaptacja fizjologiczna, reakcje na choroby… wszystko to wpada do wszechobejmującej epigenetyki. A oto inna definicja, cytowana przez Mary Jane West-Eberhard w Developmental Plasticity and Evolution. Czynniki epigenetyczne definiuje się jako:
Żeby skomplikować sprawy jeszcze bardziej, przejrzałem długi szereg podręczników biologii rozwojowej na półce w moim gabinecie i większość nawet nie wspomina epigenetyki. Oczywiście nie dlatego, że nie jest ważna, ale ponieważ biologia rozwojowa zasadniczo traktuje epigenetykę jako coś całkowicie oczywistego – rozwój jest epigenetyką w działaniu! Porównajmy naskórkową komórkę keratynocyt i trzustkową komórkę groniastą a odkryjemy, że mają dokładnie ten sam genom i że ich głębokie różnice morfologiczne, fizjologiczne i biochemiczne są wyłącznie produktem modyfikacji epigenetycznych. Rozwój jest procesem hierarchicznym z progresywnym, epigenetycznym ograniczaniem losów komórek danej linii – dzieląca się populacja komórek rozwija się od totipotencji do pluripotencji potem do multipotencji, a wreszcie do komórki należącej do specyficznego typu dzięki dziedzicznym zmianom w ekspresji genów; przypadki, w których występuje modyfikacja DNA, jak w układzie odpornościowym, są wyjątkami. Źródłem problemu jest częściowo to, że wpadamy w sztuczną dychotomię: że istnieje gen jako dająca się policzyć, wyraźna jednostka, którą można wyciągnąć i zmapować jako ustaloną sekwencję w bazie danych komputera oraz wszystkie te nieuporządkowane procesy komórkowe, które wpływają na to, co gen robi w komórce. A potem zbyt usilnie próbujemy zaklasyfikować je jako coś odrębnego. Bardzo to przypomina kontrowersję „natura-środowisko”, gdzie prawdziwy problem biologiczny nie mieści się w tych prostych, pojęciowych szufladkach i zbyt usilnie staramy się rozróżnić to, co nierozróżnialne. Ludzie, myślcie całościowo! Jesteście wytworem genów oraz komórkowych i środowiskowych interakcji. Przy naszym obecnym stanie wiedzy możemy jednak na bieżąco je oddzielać. Możemy dostać się do komórki albo wejść w bazę danych on-line i wyciągnąć sekwencję DNA, jak ten mały skrawek z ludzkiego chromosomu 15: gaattctact aatgtttaaa aaattaatac caataaagtc ttacaaaaat atagaagtag Możemy także zobaczyć jak mutacje, które zmieniają tę sekwencję, wpływają na organizm i możemy także zobaczyć tę sekwencję przekazywaną z rodzica na dziecko. To są cechy genetyczne; charakteryzuje je ogólna stabilność z odchyleniami, które są fascynującymi i ważnymi wyjątkami. Epigenetyka jest bardziej nieuporządkowana i płynna i dlatego trudniej ją określić. Genom nie jest w rzeczywistości prostą sekwencją liter, jest to bardziej skomplikowana struktura chemiczna powiązana białkami nazywanymi histonami, które tworzą kompleks zwany chromatyną. Właśnie bezpośrednio z nim pracują komórki, kiedy wykonują „program genetyczny”: 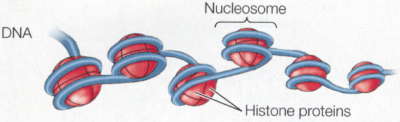 Nici DNA (niebieskie) owijają się wokół szpulek histonów tworząc jednostkę zwaną nukleosomem; te jednostki są złożone i zwinięte w wielkie splątane pętle i zwoje, czyli chromatynę. One właśnie modyfikowane są przez procesy epigenezy. Możemy zaliczyć te procesy do kilku różnych kategorii. Dwie z nich to np. metylacja DNA i modyfikacja samych histonów. 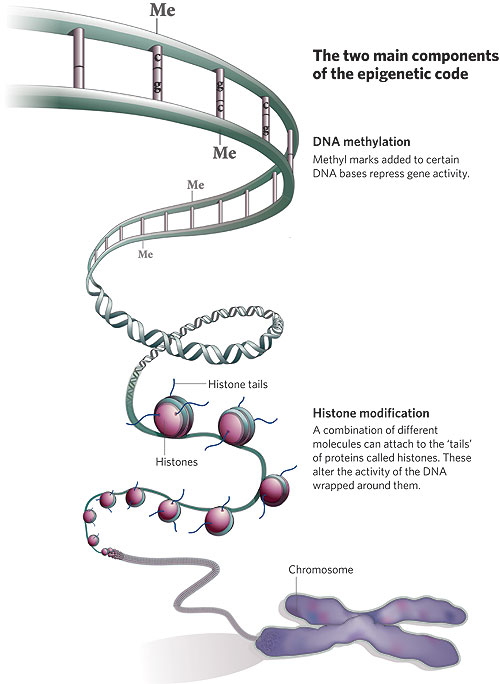 · Modyfikacja DNA. Odcinki DNA można inaktywować przez kowalentne dołączanie grup metylowych, co może zakłócać wiązanie enzymów transkrypcyjnych i może także być sygnałem do przyłączenia enzymów modyfikujących połączone histony. W komórkach obecne są enzymy zwane metylotransferazami, które związują się ze specyficznymi dinukleotydami (cytozyna przyłączona do guaniny) i przyłączają grupę metylową do cytozyny. Metylowany DNA to milczący DNA. · Modyfikacja histonów. Kompleksy histonów są, z grubsza biorąc, kuliste ale mają także swobodne „ogony" na N-końcach, które mogą również być modyfikowane kowalentnie przez acetylację, fosforylację, ubikwitynację lub metylację. Te zmiany wpływają na to, jak ciasno upakowana będzie chromatyna: w luźno upakowanej chromatynie, zwanej euchromatyną, DNA jest łatwiej dostępny i aktywniejszy, podczas gdy w ciasno upakowanej chromatynie (heterochromatynie) DNA jest mniej aktywny. · Rodzaje histonów. Histony nie są do siebie podobne! Niektóre rodzaje łatwiej przyzwalają na transkrypcję, podczas gdy inne ułatwiają ściślejsze upakowanie. Aktywność danego odcinka DNA może być modulowana za pomocą rodzaju użytych histonów. · Ustawienie chromosomów. Istnieje coraz więcej dowodów na to, że przynajmniej niektóre aspekty trójwymiarowego ustawienia DNA w jądrze nie są przypadkowe – to znaczy, że DNA nie jest byle jak splątanym kłębem spaghetti, ale składa się w pewne specyficzne sposoby, które łączą szeroko rozrzucone regiony. Jednym z najładniejszych przykładów tego jest kontrola receptorów węchowych u myszy: przy pomocy nieznanych mechanizmów pojedynczy specyficzny gen receptorowy podlega aktywacji w komórce węchowej dzięki skojarzeniu odległego elementu wzmacniającego z pojedynczym genem receptorowym. · Wszystkie inne mechanizmy regulacji genów. Łatwo traktować dziedziczne modyfikacje DNA jako czynniki epigenetyczne, ale niemal każdy mechanizm regulacyjny jest w pewnym sensie dziedziczny. Na przykład koncentracja czynników transkrypcyjnych i RNA w cytoplazmie wpływa na poziom aktywności genu… i te czynniki także są przekazywane w mitozie. Szczególnie według podanej powyżej definicji Westa-Eberharda epigenetyka otwiera się w olbrzymi katalog wszystkiego, co modyfikuje ekspresję genów. A może kilka przykładów? Jednym wyraźnym przykładem długoterminowej modyfikacji epigenetycznej jest inaktywacja chromosomu X. Samice ssaków mają dwa chromosomy X, podczas gdy samce mają tylko jeden, co mogłoby tworzyć problemy różnicy dawki – bez żadnej regulacji samice miałyby dwukrotną koncentrację produktów genów znajdujących się na chromosomie X, a wiemy, że różnice koncentracji wpływają na wiele efektów genetycznych. Strategią ssaków nie jest zmuszanie X w samcach do podwójnie ciężkiej pracy, by zrekompensować brak, ale zamykanie całego jednego chromosomu u samic. Dzieje się to w dużej mierze przez rozległą metylację histonów w inaktywowanym X oraz przez rekrutowanie represyjnych odmian histonów. Chromosom zostaje heterochromatyzowany, żeby go zamknąć. Mechanizmy dziedziczenia decydują o tym, który chromosom X zostaje wyciszony. Jeśli komórka w żeńskim embrionie przypadkiem zamyka chromosom X odziedziczony od matki, pozostawiając ojcowski chromosom w stanie aktywności, wszystkie jej komórki potomne także zamkną ten sam X. Od tego momentu jest to już ustalone; potomstwo tej komórki od wczesnego stanu embrionalnego aż do śmierci samicy będzie używało tego samego X. Jest to zdecydowanie zobowiązanie długoterminowe. Inne interesujące zjawisko występuje w embrionach ssaków łożyskowych. Początkowo ojcowski chromosom X (to jest ten, który znajduje się w plemniku) zawsze jest nieaktywny i najwcześniejsze stadia rozwoju odbywają się tylko przy pomocy matczynego chromosomu X. Pozaembrionalne tkanki trwają przy tym wzorze, ale sam embrion później na krótko aktywuje wszystkie chromosomy X, a następnie u samic losowo zamyka jeden z nich. Prowadzi to do interesującej sytuacji, że samice ssaków na ogół są mozaikami z niewidzialnie (poza trójbarwnymi kotami) łaciatymi komórkami, które arbitralnie zamknęły jeden lub drugi chromosom X. To ten właśnie wybór jest ustalony na resztę życia osobnika. Innym przypadkiem jest piętnowanie genomowe. Nie jest tylko tak, że chromosom X zostaje aktywowany lub inaktywowany zależnie od tego, czy jest ojcowski czy matczyny; różnice występują także na innych, nie płciowych chromosomach. Najlepiej znanym przykładem jest zespół genów na ludzkim chromosomie 15. U mężczyzn pewne geny są wyciszone; u kobiet wyciszony jest inny zestaw genów w tej samej okolicy. Wzór inaktywacji jest zachowany w plemnikach i komórkach jajowych, a więc komórki plemnikowe zawsze mają chromosom 15 z tymi genami poddanymi metylacji, podczas gdy jaja w podobny sposób mają żeński wzór inaktywacji. Normalnie nie ma to żadnych dających się wykryć konsekwencji dla płodu. Płód ma jedną ojcowską i jedną matczyną kopię chromosomu 15, a więc nadal ma jedną kopię każdego genu, który jest całkowicie funkcjonalny. Wszystko jest w porządku. Istnieją jednak sytuacje, kiedy płód musi polegać na jednym tylko chromosomie i wtedy mogą zacząć się kłopoty. Co się stanie, jeśli plemnik ma chromosom 15 z wadliwym allelem albo z całkowitą delecją? Wtedy płód musi użyć matczynej kopii chromosomu 15, ale co się dzieje, jeśli ten allel jest inaktywowany bądź macierzyńsko piętnowany? Wtedy płód nie ma właściwej kopii tego genu do użycia podczas rozwoju. Inna sytuacja nazywa się jednorodzicielską disomią. Czasami podczas mitozy lub mejozy występują błędy zwane nierozdzielnością, w których komórka dziedziczy dodatkową kopię chromosomu (dobrze znanym przykładem jest zespół Downa, w którym osobnik ma dodatkową kopię chromosomu 21). Trisomia lub dodatkowa kopia chromosomu 15 jest dla płodu zabójcza, a więc ciąża nigdy nie jest donoszona. Czasami jednak dodatkowa pomyłka – utrata jednego z dodatkowych chromosomów – może spontanicznie uratować taki płód redukując liczbę kopii chromosomu 15 z powrotem do dwóch. I tutaj jest problem: kopia usuwana jest losowo. Jeśli osobnik ma dwie kopie macierzyńskiego chromosomu 15 i jedną kopię ojcowskiego chromosomu 15 i traci ojcowski chromosom, to nie jest już trisomiczny, ale ma dwa chromosomy z tylko matczynym piętnowaniem. To także może mieć poważne konsekwencje. Osoby, które rozwijają się z tylko matczynie piętnowanymi kopiami tych genów na chromosomie 15 mają coś, co nazywa się zespołem Prader-Williego, charakteryzującym się niedorozwojem umysłowym, otyłością i niskim wzrostem; jeśli zamiast tego mają tylko kopie ojcowsko piętnowanego chromosomu 15, mają zespół Angelmana, z poważnym niedorozwojem umysłowym, charakterystycznymi zmianami rysów twarzy i ruchów (w pierwotnym opisie nazywano je „dziećmi marionetkami” z powodu ich wyglądu i nerwowych ruchów kończyn). Te osobniki mogą mieć identyczne genotypy, a jedyną różnicą są epigenetyczne modyfikacje ich chromosomów. Innym problemem jest rola epigenetyki w powstawaniu chorób. Pewne choroby chroniczne, takie jak marskość wątroby, są czymś więcej niż ostrą reakcją na atak środowiskowy – reprezentują one długoterminowe zmiany w ekspresji genów w liniach komórkowych narządu. Nasze komórki są wrażliwe i mogą zmieniać się epigenetycznie przez całe życie. Rozwojowi niektórych nowotworów wydaje się sprzyjać coś zwane epimutacjami – zmiany nie w samym DNA, ale we wzorze metylacji, która inaktywuje geny odgrywające rolę w naszej obronie przeciwko rakowi. Na przykład epigenetyczne wyciszanie genu MLH1 jest związane z niektórymi nowotworami okrężnicy i odbytnicy. Jednym ze sposobów, na jakie mogą zaatakować nas wirusy, jest wstawienie swoich genomów do naszego – wprowadzają dramatyczną zmianę, która może być szkodliwa i która może być przekazywana przez dzielące się komórki. Procesy epigenetyczne są obroną przeciwko propagacji infekcji wirusowych. Metylotransferaza może przetoczyć się przez genom i uciszyć wirusowe wstawki, nie pozwalając im na sprzyjanie rozprzestrzenianiu się wirusa. Zacząłem to od paru definicji epigenetyki. Być może prostszym, nietechnicznym sposobem myślenia o tym wszystkim jest, że reprezentuje rodzaj pamięci komórkowej, którą można przekazać do komórek potomnych. Nie jest to tak konkretne jak sekwencja DNA, ale jest wystarczające do odtworzenia stanu aktywności genów między pokoleniami. Jest to zasadnicze dla zrozumienia tak rozwoju, jak i sposobu w jaki organizm współdziała ze swoim środowiskiem. Jest to ze sobą splecione i nie daje się oddzielić od naszej wiedzy o genie. Bibliografia
Tekst opublikowany był w blogu Pharyngula 22 lipca, 2008.
« Biologia molekularna (Publikacja: 26-09-2008 )
str. 6098 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [ Regulamin publikacji ] [ Bannery ] [ Mapa portalu ] [ Reklama ] [ Sklep ] [ Zarejestruj się ] [ Kontakt ] Racjonalista © Copyright 2000-2018 (e-mail: redakcja | administrator) | ||





 Ur 1957. Amerykański profesor biologii na uniwersytecie w Minnesocie, prowadzi również popularyzujący naukę blog
Ur 1957. Amerykański profesor biologii na uniwersytecie w Minnesocie, prowadzi również popularyzujący naukę blog