 |
Chcesz wiedzieć więcej?
Zamów dobrą książkę.
Propozycje Racjonalisty: | | |
   |
|
|
 |
« Nauka Złożoność wyjaśniona. Część 8. [1] Autor tekstu: Vinod K. Wadhawan
Ewolucja złożoności chemicznej
 Jak powstało życie na Ziemi? Chemiczna lub molekularna ewolucja poprzedziła
pojawienie się życia. Pod wpływem energii niskiej entropii ze Słońca i wspomagane przez obecność pewnych skał, atomy i cząsteczki przeszły reakcje
chemiczne, których rezultatem było pojawienie się cząsteczek o coraz wyższej
zawartości informacyjnej lub złożoności. W tym artykule wyjaśniam, jak to się
zdarzyło.
Jak powstało życie na Ziemi? Chemiczna lub molekularna ewolucja poprzedziła
pojawienie się życia. Pod wpływem energii niskiej entropii ze Słońca i wspomagane przez obecność pewnych skał, atomy i cząsteczki przeszły reakcje
chemiczne, których rezultatem było pojawienie się cząsteczek o coraz wyższej
zawartości informacyjnej lub złożoności. W tym artykule wyjaśniam, jak to się
zdarzyło.
8.1 Od atomów do cząsteczek
Chemiczny symbol H jest używany dla atomu wodoru, który jest pierwszym
pierwiastkiem w układzie okresowym pierwiastków. Ma jądro, które w tym wypadku
jest tylko protonem, i jest tam elektron krążący wokół jądra. Elektron ma
ładunek ujemny, dokładnie równy wielkością dodatniemu ładunkowi protonu.
Przyjmując tę wielkość jako ładunek jednostkowy, mówimy, że atom H ma liczbę
atomową 1 (Z=1). Przyjmując masę protonu za jednostkę masy mówimy, że H ma
liczbę masową 1(A=1). Elektron jest ~2000 razy lżejszy niż proton.
Pierwiastkiem numer 2 w układzie okresowym jest hel (symbol chemiczny He). Ma
dwa protony w jądrze i dwa elektrony krążące wokół jądra. W jądrze są także dwa
neutrony. Neutrony otrzymały swoją nazwę, ponieważ nie mają ładunku. Masa
neutronu niezbyt różni się od masy protonu. Tak więc dla atomu He, Z=2 i A=4.
Życie na Ziemi oparte jest na chemii organicznej tj. chemii atomu węgla,
oznaczanego przez symbol C. Dla tego atomu Z=6 i A=12.
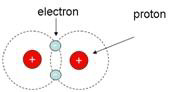
Cząsteczka
wodoru oznaczona jest symbolem H2. Składa się z dwóch jąder wodoru i są tam dwa krążące wokół nich elektrony. Dlaczego wodór „woli" istnieć jako H2
niż jako H? Ponieważ H2 jest stabilniejszy niż H. Dlaczego? Rozważmy
dwa elektrony H2. Mechanika kwantowa powiada, że nie mają one
indywidualności i są dlatego nierozróżnialne. Popatrzmy na jeden z nich.
Ponieważ ładunki dodatni i ujemny przyciągają się, elektrony pozostają blisko (ale
nie za blisko) tych dwóch jąder. [Gdyby nie zasada nieoznaczoności
Heisenberga, elektrony wszystkich atomów wpadłyby prosto do swoich jąder i nie byłoby nas tutaj, żeby dyskutować o chemicznej złożoności!] Naturalnie,
dodatnie ładunki dwóch jąder H2 są lepsze niż tylko jeden dodatni
ładunek w H2, kiedy chodzi o wywieranie siły przyciągania na
elektron. Tak więc H2 jest stabilniejszy (ma niższą energię
wewnętrzną) niż H, ponieważ jest silniej związany. Tak więc atomy H tworzą
cząsteczki H2, ponieważ dzięki temu zmniejsza się ogólna energia
swobodna (druga zasada termodynamiki wymaga, by energia swobodna była tak mała,
jak to możliwe). Tworzenie się H2 z dwóch atomów H jest przykładem
ewolucji złożoności chemicznej. Potrzeba więcej informacji do opisu struktury i funkcji H2 niż H.
Jaka jest natura wiązania między dwoma atomami H2 lub H-H? Opisuje
się je jako wiązanie kowalentne. Każdy z dwóch atomów H daje swój
elektron do chemicznego wiązania między nimi i te dwa elektrony w rejonie
wiążącym należą do obu jąder.
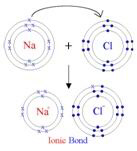
 Innym rodzajem chemicznego wiązania jest tak zwane
wiązanie elektrowalentne (zwane także wiązaniem jonowym). Jest to
wiązanie, które zachodzi między odwrotnie naładowanymi jonami. Weźmy
chlorek sodu (NaCl). Dla atomu Na Z=11 i dla atomu chlorku Z=17. Prawa mechaniki
kwantowej są takie, że atom Na jest stabilniejszy, jeśli jest otoczony przez
tylko10 elektronów zamiast 11. Podobnie Cl jest stabilniejsze, jeśli ma 18
elektronów zamiast 17. Razem mogą rozwiązać ten problem przez skłonność do
„jonizacji"; tj. atom Na może stać się dodatnio naładowanym jonem Na+
przez utratę elektronu (zwanego elektronem walencyjnym), a atom Cl może
stać się ujemnie naładowanym jonem Cl- przez zyskanie elektronu. Te
dwa odwrotnie naładowane jony mogą obniżyć energię potencjalną (a więc energię
swobodną) przez zbliżenie się do siebie, tworząc między sobą wiązanie jonowe. Innym rodzajem chemicznego wiązania jest tak zwane
wiązanie elektrowalentne (zwane także wiązaniem jonowym). Jest to
wiązanie, które zachodzi między odwrotnie naładowanymi jonami. Weźmy
chlorek sodu (NaCl). Dla atomu Na Z=11 i dla atomu chlorku Z=17. Prawa mechaniki
kwantowej są takie, że atom Na jest stabilniejszy, jeśli jest otoczony przez
tylko10 elektronów zamiast 11. Podobnie Cl jest stabilniejsze, jeśli ma 18
elektronów zamiast 17. Razem mogą rozwiązać ten problem przez skłonność do
„jonizacji"; tj. atom Na może stać się dodatnio naładowanym jonem Na+
przez utratę elektronu (zwanego elektronem walencyjnym), a atom Cl może
stać się ujemnie naładowanym jonem Cl- przez zyskanie elektronu. Te
dwa odwrotnie naładowane jony mogą obniżyć energię potencjalną (a więc energię
swobodną) przez zbliżenie się do siebie, tworząc między sobą wiązanie jonowe.
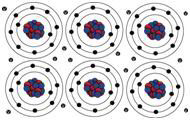
 Trzecim ważnym i ogólnie silnym wiązaniem jest
wiązanie metaliczne. Zachodzi w metalach takich jak aluminium (Al), miedź
(Cu), srebro (Ag), złoto (Au) itd. Weźmy przypadek Al. Dla niego Z=13. Ale,
podobnie jak atom Na omawiany wyżej, jest bardziej stabilny, jeśli ma tylko 10
elektronów wokół jądra. Tak więc atomy Al, kiedy są blisko jeden drugiego, tracą
trzy elektrony walencyjne do wspólnej puli i te elektrony walencyjne stają się
wspólną własnością wszystkich jonów Al. Kawałek metalu Al trzyma się razem
dzięki tej chmurze ujemnie naładowanych elektronów, kompensujących dodatnie
ładunki jonów Al. Trzecim ważnym i ogólnie silnym wiązaniem jest
wiązanie metaliczne. Zachodzi w metalach takich jak aluminium (Al), miedź
(Cu), srebro (Ag), złoto (Au) itd. Weźmy przypadek Al. Dla niego Z=13. Ale,
podobnie jak atom Na omawiany wyżej, jest bardziej stabilny, jeśli ma tylko 10
elektronów wokół jądra. Tak więc atomy Al, kiedy są blisko jeden drugiego, tracą
trzy elektrony walencyjne do wspólnej puli i te elektrony walencyjne stają się
wspólną własnością wszystkich jonów Al. Kawałek metalu Al trzyma się razem
dzięki tej chmurze ujemnie naładowanych elektronów, kompensujących dodatnie
ładunki jonów Al.
8.2 Wiązanie wodorowe i wiązanie van der Waalsa
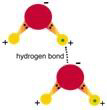 Opisane powyżej wiązania kowalentne, elektrowalentne i metaliczne są tak zwanymi wiązaniami pierwotnymi. Są to silne wiązania.
Na przykład diament składa się z kowalentnie związanych atomów węgla i jest
bardzo twardym materiałem. Także w metalach atomy są silnie związane ze sobą,
jak również w kryształach chlorku sodu, w których dominuje interakcja
elektrowalentna. Istnieje szereg innych typów wiązań lub interakcji, które są
znacznie słabsze, ale bardzo ważne, szczególnie dla układów biologicznych i ogólnie dla miękkiej materii. Szczególnie wszechobecne jest wiązanie
wodorowe. Weźmy przykład wody, H2O lub H-O-H. Atom tlenu tworzy
kowalentne wiązania z dwoma atomami wodoru. Każde takie kowalentne wiązanie (O-H)
ma stowarzyszone z nim dwa elektrony, jeden pochodzący z wodoru i jeden z tlenu.
Dystrybucja elektronu wokół dwóch jąder wodoru w takim wiązaniu nie jest taka
jak w symetrycznym wiązaniu C-C w strukturze diamentu. Jądro tlenu ma
liczbę atomową 8, co jest znacznie więcej niż liczba atomowa 1 wodoru, a więc
okupuje większą część chmury ładunku elektronu stowarzyszonego z wiązaniem
(mówimy, że atom tlenu jest bardzo elektroujemny). To powoduje, że jądro
atomu wodoru jest nieco mniej osłonięte przez elektron, który krążył wokół
niego, kiedy nie było żadnego rodzaju wiązania. Z podobnych przyczyn jądro tlenu i jego chmura ładunku elektronów są razem trochę bardziej ujemne niż byłyby w izolowanym atomie O. Końcowym wynikiem jest to, że cząsteczka wody jest jak mały
dipol (dwubiegun). Ma twa dodatnie końce i jeden ujemny. Wszystkie
cząsteczki wody są dipolami, a więc ustawiają się tak, że dodatni koniec
(wodorowy) jednej cząsteczki wskazuje ku ujemnemu końcowi (tlenowemu) drugiej
cząsteczki. Mówimy więc o wiązaniu wodorowym, oznaczonym w tym przykładzie przez
O-H...O. Opisane powyżej wiązania kowalentne, elektrowalentne i metaliczne są tak zwanymi wiązaniami pierwotnymi. Są to silne wiązania.
Na przykład diament składa się z kowalentnie związanych atomów węgla i jest
bardzo twardym materiałem. Także w metalach atomy są silnie związane ze sobą,
jak również w kryształach chlorku sodu, w których dominuje interakcja
elektrowalentna. Istnieje szereg innych typów wiązań lub interakcji, które są
znacznie słabsze, ale bardzo ważne, szczególnie dla układów biologicznych i ogólnie dla miękkiej materii. Szczególnie wszechobecne jest wiązanie
wodorowe. Weźmy przykład wody, H2O lub H-O-H. Atom tlenu tworzy
kowalentne wiązania z dwoma atomami wodoru. Każde takie kowalentne wiązanie (O-H)
ma stowarzyszone z nim dwa elektrony, jeden pochodzący z wodoru i jeden z tlenu.
Dystrybucja elektronu wokół dwóch jąder wodoru w takim wiązaniu nie jest taka
jak w symetrycznym wiązaniu C-C w strukturze diamentu. Jądro tlenu ma
liczbę atomową 8, co jest znacznie więcej niż liczba atomowa 1 wodoru, a więc
okupuje większą część chmury ładunku elektronu stowarzyszonego z wiązaniem
(mówimy, że atom tlenu jest bardzo elektroujemny). To powoduje, że jądro
atomu wodoru jest nieco mniej osłonięte przez elektron, który krążył wokół
niego, kiedy nie było żadnego rodzaju wiązania. Z podobnych przyczyn jądro tlenu i jego chmura ładunku elektronów są razem trochę bardziej ujemne niż byłyby w izolowanym atomie O. Końcowym wynikiem jest to, że cząsteczka wody jest jak mały
dipol (dwubiegun). Ma twa dodatnie końce i jeden ujemny. Wszystkie
cząsteczki wody są dipolami, a więc ustawiają się tak, że dodatni koniec
(wodorowy) jednej cząsteczki wskazuje ku ujemnemu końcowi (tlenowemu) drugiej
cząsteczki. Mówimy więc o wiązaniu wodorowym, oznaczonym w tym przykładzie przez
O-H...O.
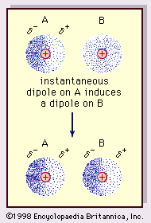 Najbardziej istotnym aspektem wiązania wodorowego w ewolucji chemicznej i biologicznej złożoności jest to, że jest ono stosunkowo słabe, nie tak
silne jak wiązanie kowalentne, ale nie tak słabe jak tak zwane wiązanie van der
Waalsa (lub oddziaływanie dyspersyjne Londona). Oddziaływanie van der Waalsa
jest bardzo słabe, chociaż zawsze obecne między dwoma atomami. Fluktuacje
kwantowo-mechaniczne w chmurze ładunku elektronicznego wokół atomu mogą
spowodować przejściowe rozdzielenie ładunku lub moment dipolowy albo multipolowy, a pole elektryczne tego multipola indukuje moment multipolowy w każdym sąsiednim
atomie. Powoduje to małe przyciąganie miedzy dwoma atomami.
Najbardziej istotnym aspektem wiązania wodorowego w ewolucji chemicznej i biologicznej złożoności jest to, że jest ono stosunkowo słabe, nie tak
silne jak wiązanie kowalentne, ale nie tak słabe jak tak zwane wiązanie van der
Waalsa (lub oddziaływanie dyspersyjne Londona). Oddziaływanie van der Waalsa
jest bardzo słabe, chociaż zawsze obecne między dwoma atomami. Fluktuacje
kwantowo-mechaniczne w chmurze ładunku elektronicznego wokół atomu mogą
spowodować przejściowe rozdzielenie ładunku lub moment dipolowy albo multipolowy, a pole elektryczne tego multipola indukuje moment multipolowy w każdym sąsiednim
atomie. Powoduje to małe przyciąganie miedzy dwoma atomami.
Miarą siły wiązania chemicznego jest energia wymagana do jego rozerwania.
Temperatura topnienia ciała stałego jest wskazówką siły jego najsłabszego
wiązania. Wiązanie kowalentne jest najsilniejsze, z typową energią wiązania ~400
kilokalorii (kcal). Wiązanie elekrowalentne jest zwykle o połowę słabsze.
Wiązanie metaliczne wykazuje szeroki wachlarz siły, a dwoma skrajnymi
przykładami jest wiązanie w rtęci na jednym krańcu i wiązanie w wolframie na
drugim. Siła wiązania wodorowego zwykle wynosi 14 kcal. Wiązanie van der Waalsa
zaś wymaga energii poniżej 1 kcal. Najbardziej istotnym faktem dla naszych
rozważań tutaj jest to, że energia wymagana w wiązaniu wodorowym jest zwykle
tylko ~10 razy większa od energii fluktuacji temperatury, ale nadal znacznie
niższa od energii typowego wiązania kowalentnego. W typowych temperaturach, w których istnieją układy biologiczne, fluktuacjom temperatury trudno jest
rozerwać wiązania kowalentne, ale istnieje dość wysoka szansa, że mogą rozerwać
wiązania wodorowe.
8.3
Oddziaływania hydrofobowe i hydrofilowe
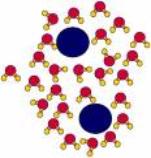 Widzieliśmy powyżej, że woda jest skupiskiem maleńkich dipoli. Mówimy, że jest
to materiał polarny. Natomiast istnieje duża liczba „węglowodorów", które są
materiałami niepolarnymi. [Węglowodór jest związkiem składającym się głównie z atomów wodoru i węgla]. W odróżnieniu od wiązania O-H w wodzie, które jest
wiązaniem z momentem dipolowym, wiązanie C-H w węglowodorze jest w przeważającym
stopniu niepolarne: dwa elektrony tworzące wiązanie kowalentne C-H dzielą się
niemal równo między C i H. Tak więc wiązanie C-H nie powoduje tworzenia dipolu i dlatego nie tworzy wiązania wodorowego z cząsteczką wody. A teraz załóżmy, że
mieszamy płyny polarne i niepolarne. Zajdzie segregacja. Molekuły
niepolarne będą miały tendencję do zbierania się razem, ponieważ nie mogą brać
udziału w wiązaniu wodorowym. Mają rodzaj „fobii" wobec cząsteczek wody, a więc
mówimy o oddziaływaniu hydrofobowym. Ponieważ wiązanie wodorowe jest średniej
siły, także oddziaływanie hydrofobowe jest średniej siły.
Widzieliśmy powyżej, że woda jest skupiskiem maleńkich dipoli. Mówimy, że jest
to materiał polarny. Natomiast istnieje duża liczba „węglowodorów", które są
materiałami niepolarnymi. [Węglowodór jest związkiem składającym się głównie z atomów wodoru i węgla]. W odróżnieniu od wiązania O-H w wodzie, które jest
wiązaniem z momentem dipolowym, wiązanie C-H w węglowodorze jest w przeważającym
stopniu niepolarne: dwa elektrony tworzące wiązanie kowalentne C-H dzielą się
niemal równo między C i H. Tak więc wiązanie C-H nie powoduje tworzenia dipolu i dlatego nie tworzy wiązania wodorowego z cząsteczką wody. A teraz załóżmy, że
mieszamy płyny polarne i niepolarne. Zajdzie segregacja. Molekuły
niepolarne będą miały tendencję do zbierania się razem, ponieważ nie mogą brać
udziału w wiązaniu wodorowym. Mają rodzaj „fobii" wobec cząsteczek wody, a więc
mówimy o oddziaływaniu hydrofobowym. Ponieważ wiązanie wodorowe jest średniej
siły, także oddziaływanie hydrofobowe jest średniej siły.
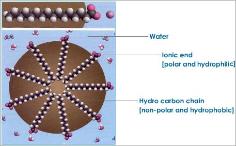 Istnieje wiele rodzajów związków organicznych, które
mają przeważającą strukturę węglowodorową, ale przyczepione do nich są
polarne grupy funkcjonalne. Przykładami tego rodzaju związków są
cholesterol, kwasy tłuszczowe i fosfolipidy. Takie cząsteczki mają niepolarny i hydrofobowy koniec oraz polarny, hydrofilowy koniec. Włożone do wody gromadzą
się same tak, że hydrofilowe końce kierują się ku wodzie, a hydrofobowe są
odsunięte, unikając kontaktu z wodą. To dlatego olej nie miesza się z wodą.
Natomiast alkohol i woda mieszają się tak łatwo, że nie potrzeba ich mieszać;
oba są płynami polarnymi. Zapomniałem nazwiska króla, który powiedział: „Nie
interesuje mnie, gdzie płynie woda, jak długo nie dostaje się do mojego wina!" Istnieje wiele rodzajów związków organicznych, które
mają przeważającą strukturę węglowodorową, ale przyczepione do nich są
polarne grupy funkcjonalne. Przykładami tego rodzaju związków są
cholesterol, kwasy tłuszczowe i fosfolipidy. Takie cząsteczki mają niepolarny i hydrofobowy koniec oraz polarny, hydrofilowy koniec. Włożone do wody gromadzą
się same tak, że hydrofilowe końce kierują się ku wodzie, a hydrofobowe są
odsunięte, unikając kontaktu z wodą. To dlatego olej nie miesza się z wodą.
Natomiast alkohol i woda mieszają się tak łatwo, że nie potrzeba ich mieszać;
oba są płynami polarnymi. Zapomniałem nazwiska króla, który powiedział: „Nie
interesuje mnie, gdzie płynie woda, jak długo nie dostaje się do mojego wina!"
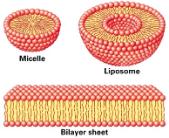
Dzięki oddziaływaniu hydrofobowemu mogą powstać piękne samoporządkujące się (self-assembled)
micele, liposomy i warstwy bimolekularne.
8.4 Rozpoznanie molekularne i samoporządkowanie
 Popatrzmy na szczegóły tego, jak zachodzi obniżanie
energii swobodnej na skalę atomową. Jeśli dwa atomy są blisko siebie, zwiążą
się, żeby stworzyć cząsteczkę, jeśli cząsteczka ma niższą energię swobodną niż
te dwa oddzielne atomy. Rozważmy następnie możliwe wiązania między
cząsteczkami, żeby stworzyć jeszcze większe zespoły (lub "zespoły
supramolekularne"). To robi się teraz ciekawsze. Istotne staje się tutaj
ważne pojęcie rozpoznania molekularnego. Taki rodzaj cząsteczek, które
mają pewien stopień komplementarności, będzie z pewnym
prawdopodobieństwem tworzyć zespoły. Mamy dwa rodzaje komplementarności do
rozważenia: kształty „zamka i klucza" oraz komplementarne rozkłady
ładunku (pamiętajmy, dodatni przyciąga ujemny). Jeśli istnieją te
komplementarności, umożliwiają one dwóm cząsteczkom dokładne dopasowanie do
siebie, obniżając w ten sposób ogólną energię potencjalną, a więc energię
swobodną. Jest to bardziej stabilna konfiguracja, ponieważ fluktuacje
temperatury mają mniejszą możliwość rozdzielenia dobrze dopasowanych cząsteczek i to jest istotą samoporządkowania w Naturze. Samoporządkowanie jest jak
wzrost kryształu, tyle tylko, że końcowy produkt może nieść znacznie więcej
informacji, tj. jest bardziej złożony. Popatrzmy na szczegóły tego, jak zachodzi obniżanie
energii swobodnej na skalę atomową. Jeśli dwa atomy są blisko siebie, zwiążą
się, żeby stworzyć cząsteczkę, jeśli cząsteczka ma niższą energię swobodną niż
te dwa oddzielne atomy. Rozważmy następnie możliwe wiązania między
cząsteczkami, żeby stworzyć jeszcze większe zespoły (lub "zespoły
supramolekularne"). To robi się teraz ciekawsze. Istotne staje się tutaj
ważne pojęcie rozpoznania molekularnego. Taki rodzaj cząsteczek, które
mają pewien stopień komplementarności, będzie z pewnym
prawdopodobieństwem tworzyć zespoły. Mamy dwa rodzaje komplementarności do
rozważenia: kształty „zamka i klucza" oraz komplementarne rozkłady
ładunku (pamiętajmy, dodatni przyciąga ujemny). Jeśli istnieją te
komplementarności, umożliwiają one dwóm cząsteczkom dokładne dopasowanie do
siebie, obniżając w ten sposób ogólną energię potencjalną, a więc energię
swobodną. Jest to bardziej stabilna konfiguracja, ponieważ fluktuacje
temperatury mają mniejszą możliwość rozdzielenia dobrze dopasowanych cząsteczek i to jest istotą samoporządkowania w Naturze. Samoporządkowanie jest jak
wzrost kryształu, tyle tylko, że końcowy produkt może nieść znacznie więcej
informacji, tj. jest bardziej złożony.
1 2 3 Dalej..
« Nauka (Publikacja: 30-11-2009 Ostatnia zmiana: 01-12-2009)
Wszelkie prawa zastrzeżone. Prawa autorskie tego tekstu należą do autora i/lub serwisu Racjonalista.pl.
Żadna część tego tekstu nie może być przedrukowywana, reprodukowana ani wykorzystywana w jakiejkolwiek formie,
bez zgody właściciela praw autorskich. Wszelkie naruszenia praw autorskich podlegają sankcjom przewidzianym w
kodeksie karnym i ustawie o prawie autorskim i prawach pokrewnych.str. 6976 |
 |






 Jak powstało życie na Ziemi? Chemiczna lub molekularna ewolucja poprzedziła
pojawienie się życia. Pod wpływem energii niskiej entropii ze Słońca i wspomagane przez obecność pewnych skał, atomy i cząsteczki przeszły reakcje
chemiczne, których rezultatem było pojawienie się cząsteczek o coraz wyższej
zawartości informacyjnej lub złożoności. W tym artykule wyjaśniam, jak to się
zdarzyło.
Jak powstało życie na Ziemi? Chemiczna lub molekularna ewolucja poprzedziła
pojawienie się życia. Pod wpływem energii niskiej entropii ze Słońca i wspomagane przez obecność pewnych skał, atomy i cząsteczki przeszły reakcje
chemiczne, których rezultatem było pojawienie się cząsteczek o coraz wyższej
zawartości informacyjnej lub złożoności. W tym artykule wyjaśniam, jak to się
zdarzyło. Innym rodzajem chemicznego wiązania jest tak zwane
wiązanie elektrowalentne (zwane także wiązaniem jonowym). Jest to
wiązanie, które zachodzi między odwrotnie naładowanymi jonami. Weźmy
chlorek sodu (NaCl). Dla atomu Na Z=11 i dla atomu chlorku Z=17. Prawa mechaniki
kwantowej są takie, że atom Na jest stabilniejszy, jeśli jest otoczony przez
tylko10 elektronów zamiast 11. Podobnie Cl jest stabilniejsze, jeśli ma 18
elektronów zamiast 17. Razem mogą rozwiązać ten problem przez skłonność do
„jonizacji"; tj. atom Na może stać się dodatnio naładowanym jonem Na+
przez utratę elektronu (zwanego elektronem walencyjnym), a atom Cl może
stać się ujemnie naładowanym jonem Cl- przez zyskanie elektronu. Te
dwa odwrotnie naładowane jony mogą obniżyć energię potencjalną (a więc energię
swobodną) przez zbliżenie się do siebie, tworząc między sobą wiązanie jonowe.
Innym rodzajem chemicznego wiązania jest tak zwane
wiązanie elektrowalentne (zwane także wiązaniem jonowym). Jest to
wiązanie, które zachodzi między odwrotnie naładowanymi jonami. Weźmy
chlorek sodu (NaCl). Dla atomu Na Z=11 i dla atomu chlorku Z=17. Prawa mechaniki
kwantowej są takie, że atom Na jest stabilniejszy, jeśli jest otoczony przez
tylko10 elektronów zamiast 11. Podobnie Cl jest stabilniejsze, jeśli ma 18
elektronów zamiast 17. Razem mogą rozwiązać ten problem przez skłonność do
„jonizacji"; tj. atom Na może stać się dodatnio naładowanym jonem Na+
przez utratę elektronu (zwanego elektronem walencyjnym), a atom Cl może
stać się ujemnie naładowanym jonem Cl- przez zyskanie elektronu. Te
dwa odwrotnie naładowane jony mogą obniżyć energię potencjalną (a więc energię
swobodną) przez zbliżenie się do siebie, tworząc między sobą wiązanie jonowe. Trzecim ważnym i ogólnie silnym wiązaniem jest
wiązanie metaliczne. Zachodzi w metalach takich jak aluminium (Al), miedź
(Cu), srebro (Ag), złoto (Au) itd. Weźmy przypadek Al. Dla niego Z=13. Ale,
podobnie jak atom Na omawiany wyżej, jest bardziej stabilny, jeśli ma tylko 10
elektronów wokół jądra. Tak więc atomy Al, kiedy są blisko jeden drugiego, tracą
trzy elektrony walencyjne do wspólnej puli i te elektrony walencyjne stają się
wspólną własnością wszystkich jonów Al. Kawałek metalu Al trzyma się razem
dzięki tej chmurze ujemnie naładowanych elektronów, kompensujących dodatnie
ładunki jonów Al.
Trzecim ważnym i ogólnie silnym wiązaniem jest
wiązanie metaliczne. Zachodzi w metalach takich jak aluminium (Al), miedź
(Cu), srebro (Ag), złoto (Au) itd. Weźmy przypadek Al. Dla niego Z=13. Ale,
podobnie jak atom Na omawiany wyżej, jest bardziej stabilny, jeśli ma tylko 10
elektronów wokół jądra. Tak więc atomy Al, kiedy są blisko jeden drugiego, tracą
trzy elektrony walencyjne do wspólnej puli i te elektrony walencyjne stają się
wspólną własnością wszystkich jonów Al. Kawałek metalu Al trzyma się razem
dzięki tej chmurze ujemnie naładowanych elektronów, kompensujących dodatnie
ładunki jonów Al. Opisane powyżej wiązania kowalentne, elektrowalentne i metaliczne są tak zwanymi wiązaniami pierwotnymi. Są to silne wiązania.
Na przykład diament składa się z kowalentnie związanych atomów węgla i jest
bardzo twardym materiałem. Także w metalach atomy są silnie związane ze sobą,
jak również w kryształach chlorku sodu, w których dominuje interakcja
elektrowalentna. Istnieje szereg innych typów wiązań lub interakcji, które są
znacznie słabsze, ale bardzo ważne, szczególnie dla układów biologicznych i ogólnie dla miękkiej materii. Szczególnie wszechobecne jest wiązanie
wodorowe. Weźmy przykład wody, H2O lub H-O-H. Atom tlenu tworzy
kowalentne wiązania z dwoma atomami wodoru. Każde takie kowalentne wiązanie (O-H)
ma stowarzyszone z nim dwa elektrony, jeden pochodzący z wodoru i jeden z tlenu.
Dystrybucja elektronu wokół dwóch jąder wodoru w takim wiązaniu nie jest taka
jak w symetrycznym wiązaniu C-C w strukturze diamentu. Jądro tlenu ma
liczbę atomową 8, co jest znacznie więcej niż liczba atomowa 1 wodoru, a więc
okupuje większą część chmury ładunku elektronu stowarzyszonego z wiązaniem
(mówimy, że atom tlenu jest bardzo elektroujemny). To powoduje, że jądro
atomu wodoru jest nieco mniej osłonięte przez elektron, który krążył wokół
niego, kiedy nie było żadnego rodzaju wiązania. Z podobnych przyczyn jądro tlenu i jego chmura ładunku elektronów są razem trochę bardziej ujemne niż byłyby w izolowanym atomie O. Końcowym wynikiem jest to, że cząsteczka wody jest jak mały
dipol (dwubiegun). Ma twa dodatnie końce i jeden ujemny. Wszystkie
cząsteczki wody są dipolami, a więc ustawiają się tak, że dodatni koniec
(wodorowy) jednej cząsteczki wskazuje ku ujemnemu końcowi (tlenowemu) drugiej
cząsteczki. Mówimy więc o wiązaniu wodorowym, oznaczonym w tym przykładzie przez
O-H...O.
Opisane powyżej wiązania kowalentne, elektrowalentne i metaliczne są tak zwanymi wiązaniami pierwotnymi. Są to silne wiązania.
Na przykład diament składa się z kowalentnie związanych atomów węgla i jest
bardzo twardym materiałem. Także w metalach atomy są silnie związane ze sobą,
jak również w kryształach chlorku sodu, w których dominuje interakcja
elektrowalentna. Istnieje szereg innych typów wiązań lub interakcji, które są
znacznie słabsze, ale bardzo ważne, szczególnie dla układów biologicznych i ogólnie dla miękkiej materii. Szczególnie wszechobecne jest wiązanie
wodorowe. Weźmy przykład wody, H2O lub H-O-H. Atom tlenu tworzy
kowalentne wiązania z dwoma atomami wodoru. Każde takie kowalentne wiązanie (O-H)
ma stowarzyszone z nim dwa elektrony, jeden pochodzący z wodoru i jeden z tlenu.
Dystrybucja elektronu wokół dwóch jąder wodoru w takim wiązaniu nie jest taka
jak w symetrycznym wiązaniu C-C w strukturze diamentu. Jądro tlenu ma
liczbę atomową 8, co jest znacznie więcej niż liczba atomowa 1 wodoru, a więc
okupuje większą część chmury ładunku elektronu stowarzyszonego z wiązaniem
(mówimy, że atom tlenu jest bardzo elektroujemny). To powoduje, że jądro
atomu wodoru jest nieco mniej osłonięte przez elektron, który krążył wokół
niego, kiedy nie było żadnego rodzaju wiązania. Z podobnych przyczyn jądro tlenu i jego chmura ładunku elektronów są razem trochę bardziej ujemne niż byłyby w izolowanym atomie O. Końcowym wynikiem jest to, że cząsteczka wody jest jak mały
dipol (dwubiegun). Ma twa dodatnie końce i jeden ujemny. Wszystkie
cząsteczki wody są dipolami, a więc ustawiają się tak, że dodatni koniec
(wodorowy) jednej cząsteczki wskazuje ku ujemnemu końcowi (tlenowemu) drugiej
cząsteczki. Mówimy więc o wiązaniu wodorowym, oznaczonym w tym przykładzie przez
O-H...O. Najbardziej istotnym aspektem wiązania wodorowego w ewolucji chemicznej i biologicznej złożoności jest to, że jest ono stosunkowo słabe, nie tak
silne jak wiązanie kowalentne, ale nie tak słabe jak tak zwane wiązanie van der
Waalsa (lub oddziaływanie dyspersyjne Londona). Oddziaływanie van der Waalsa
jest bardzo słabe, chociaż zawsze obecne między dwoma atomami. Fluktuacje
kwantowo-mechaniczne w chmurze ładunku elektronicznego wokół atomu mogą
spowodować przejściowe rozdzielenie ładunku lub moment dipolowy albo multipolowy, a pole elektryczne tego multipola indukuje moment multipolowy w każdym sąsiednim
atomie. Powoduje to małe przyciąganie miedzy dwoma atomami.
Najbardziej istotnym aspektem wiązania wodorowego w ewolucji chemicznej i biologicznej złożoności jest to, że jest ono stosunkowo słabe, nie tak
silne jak wiązanie kowalentne, ale nie tak słabe jak tak zwane wiązanie van der
Waalsa (lub oddziaływanie dyspersyjne Londona). Oddziaływanie van der Waalsa
jest bardzo słabe, chociaż zawsze obecne między dwoma atomami. Fluktuacje
kwantowo-mechaniczne w chmurze ładunku elektronicznego wokół atomu mogą
spowodować przejściowe rozdzielenie ładunku lub moment dipolowy albo multipolowy, a pole elektryczne tego multipola indukuje moment multipolowy w każdym sąsiednim
atomie. Powoduje to małe przyciąganie miedzy dwoma atomami. Widzieliśmy powyżej, że woda jest skupiskiem maleńkich dipoli. Mówimy, że jest
to materiał polarny. Natomiast istnieje duża liczba „węglowodorów", które są
materiałami niepolarnymi. [Węglowodór jest związkiem składającym się głównie z atomów wodoru i węgla]. W odróżnieniu od wiązania O-H w wodzie, które jest
wiązaniem z momentem dipolowym, wiązanie C-H w węglowodorze jest w przeważającym
stopniu niepolarne: dwa elektrony tworzące wiązanie kowalentne C-H dzielą się
niemal równo między C i H. Tak więc wiązanie C-H nie powoduje tworzenia dipolu i dlatego nie tworzy wiązania wodorowego z cząsteczką wody. A teraz załóżmy, że
mieszamy płyny polarne i niepolarne. Zajdzie segregacja. Molekuły
niepolarne będą miały tendencję do zbierania się razem, ponieważ nie mogą brać
udziału w wiązaniu wodorowym. Mają rodzaj „fobii" wobec cząsteczek wody, a więc
mówimy o oddziaływaniu hydrofobowym. Ponieważ wiązanie wodorowe jest średniej
siły, także oddziaływanie hydrofobowe jest średniej siły.
Widzieliśmy powyżej, że woda jest skupiskiem maleńkich dipoli. Mówimy, że jest
to materiał polarny. Natomiast istnieje duża liczba „węglowodorów", które są
materiałami niepolarnymi. [Węglowodór jest związkiem składającym się głównie z atomów wodoru i węgla]. W odróżnieniu od wiązania O-H w wodzie, które jest
wiązaniem z momentem dipolowym, wiązanie C-H w węglowodorze jest w przeważającym
stopniu niepolarne: dwa elektrony tworzące wiązanie kowalentne C-H dzielą się
niemal równo między C i H. Tak więc wiązanie C-H nie powoduje tworzenia dipolu i dlatego nie tworzy wiązania wodorowego z cząsteczką wody. A teraz załóżmy, że
mieszamy płyny polarne i niepolarne. Zajdzie segregacja. Molekuły
niepolarne będą miały tendencję do zbierania się razem, ponieważ nie mogą brać
udziału w wiązaniu wodorowym. Mają rodzaj „fobii" wobec cząsteczek wody, a więc
mówimy o oddziaływaniu hydrofobowym. Ponieważ wiązanie wodorowe jest średniej
siły, także oddziaływanie hydrofobowe jest średniej siły. Istnieje wiele rodzajów związków organicznych, które
mają przeważającą strukturę węglowodorową, ale przyczepione do nich są
polarne grupy funkcjonalne. Przykładami tego rodzaju związków są
cholesterol, kwasy tłuszczowe i fosfolipidy. Takie cząsteczki mają niepolarny i hydrofobowy koniec oraz polarny, hydrofilowy koniec. Włożone do wody gromadzą
się same tak, że hydrofilowe końce kierują się ku wodzie, a hydrofobowe są
odsunięte, unikając kontaktu z wodą. To dlatego olej nie miesza się z wodą.
Natomiast alkohol i woda mieszają się tak łatwo, że nie potrzeba ich mieszać;
oba są płynami polarnymi. Zapomniałem nazwiska króla, który powiedział: „Nie
interesuje mnie, gdzie płynie woda, jak długo nie dostaje się do mojego wina!"
Istnieje wiele rodzajów związków organicznych, które
mają przeważającą strukturę węglowodorową, ale przyczepione do nich są
polarne grupy funkcjonalne. Przykładami tego rodzaju związków są
cholesterol, kwasy tłuszczowe i fosfolipidy. Takie cząsteczki mają niepolarny i hydrofobowy koniec oraz polarny, hydrofilowy koniec. Włożone do wody gromadzą
się same tak, że hydrofilowe końce kierują się ku wodzie, a hydrofobowe są
odsunięte, unikając kontaktu z wodą. To dlatego olej nie miesza się z wodą.
Natomiast alkohol i woda mieszają się tak łatwo, że nie potrzeba ich mieszać;
oba są płynami polarnymi. Zapomniałem nazwiska króla, który powiedział: „Nie
interesuje mnie, gdzie płynie woda, jak długo nie dostaje się do mojego wina!" Popatrzmy na szczegóły tego, jak zachodzi obniżanie
energii swobodnej na skalę atomową. Jeśli dwa atomy są blisko siebie, zwiążą
się, żeby stworzyć cząsteczkę, jeśli cząsteczka ma niższą energię swobodną niż
te dwa oddzielne atomy. Rozważmy następnie możliwe wiązania między
cząsteczkami, żeby stworzyć jeszcze większe zespoły (lub "zespoły
supramolekularne"). To robi się teraz ciekawsze. Istotne staje się tutaj
ważne pojęcie rozpoznania molekularnego. Taki rodzaj cząsteczek, które
mają pewien stopień komplementarności, będzie z pewnym
prawdopodobieństwem tworzyć zespoły. Mamy dwa rodzaje komplementarności do
rozważenia: kształty „zamka i klucza" oraz komplementarne rozkłady
ładunku (pamiętajmy, dodatni przyciąga ujemny). Jeśli istnieją te
komplementarności, umożliwiają one dwóm cząsteczkom dokładne dopasowanie do
siebie, obniżając w ten sposób ogólną energię potencjalną, a więc energię
swobodną. Jest to bardziej stabilna konfiguracja, ponieważ fluktuacje
temperatury mają mniejszą możliwość rozdzielenia dobrze dopasowanych cząsteczek i to jest istotą samoporządkowania w Naturze. Samoporządkowanie jest jak
wzrost kryształu, tyle tylko, że końcowy produkt może nieść znacznie więcej
informacji, tj. jest bardziej złożony.
Popatrzmy na szczegóły tego, jak zachodzi obniżanie
energii swobodnej na skalę atomową. Jeśli dwa atomy są blisko siebie, zwiążą
się, żeby stworzyć cząsteczkę, jeśli cząsteczka ma niższą energię swobodną niż
te dwa oddzielne atomy. Rozważmy następnie możliwe wiązania między
cząsteczkami, żeby stworzyć jeszcze większe zespoły (lub "zespoły
supramolekularne"). To robi się teraz ciekawsze. Istotne staje się tutaj
ważne pojęcie rozpoznania molekularnego. Taki rodzaj cząsteczek, które
mają pewien stopień komplementarności, będzie z pewnym
prawdopodobieństwem tworzyć zespoły. Mamy dwa rodzaje komplementarności do
rozważenia: kształty „zamka i klucza" oraz komplementarne rozkłady
ładunku (pamiętajmy, dodatni przyciąga ujemny). Jeśli istnieją te
komplementarności, umożliwiają one dwóm cząsteczkom dokładne dopasowanie do
siebie, obniżając w ten sposób ogólną energię potencjalną, a więc energię
swobodną. Jest to bardziej stabilna konfiguracja, ponieważ fluktuacje
temperatury mają mniejszą możliwość rozdzielenia dobrze dopasowanych cząsteczek i to jest istotą samoporządkowania w Naturze. Samoporządkowanie jest jak
wzrost kryształu, tyle tylko, że końcowy produkt może nieść znacznie więcej
informacji, tj. jest bardziej złożony.
 Induski emerytowany fizyk atomowy, współwydawca portalu PHASE TRANSITIONS, publicysta, autor wielu książek.
Induski emerytowany fizyk atomowy, współwydawca portalu PHASE TRANSITIONS, publicysta, autor wielu książek.